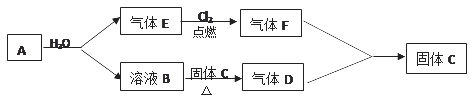
题目内容
【题目】下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH= 2K2CO3+6H2O
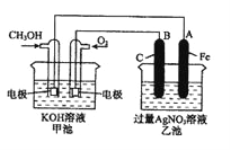
(1)乙池是__________装置。
(2)通入CH3OH的电极名称是______________________
(3)通入O2的电极的电极反应式是__________________________。若甲池用熔融碳酸盐为电解质,则通入O2的电极的电极反应式为___________________。
(4)乙池中反应的化学方程式为_______________________________。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2_________mL(标准状况下)
【答案】 电解池 负极 O2+2H2O+4e-=4OH- 2CO2+O2+4e-===2CO![]() 4AgNO3+2H2O
4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 280
4Ag+O2↑+4HNO3 280
【解析】(1)根据反应方程式知,甲装置是一个燃料电池,而乙池与甲池相连,乙池为电解池。
(2)根据2CH3OH+3O2+4KOH= 2K2CO3+6H2O知,CH3OH发生氧化反应,所以该电极是负极。
(3)根据2CH3OH+3O2+4KOH= 2K2CO3+6H2O知,O2得电子和水反应生成氢氧根离子,发生还原反应,电极反应式是O2+2H2O+4e-=4OH-;若甲池用熔融碳酸盐为电解质,则O2得电子和二氧化碳反应生成碳酸根离子,电极反应式为2CO2+O2+4e-===2CO![]() 。
。
(4)乙池中阳离子放电顺序为Ag+>H+,阴离子OH->NO3-,反应的化学方程式为4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3。
4Ag+O2↑+4HNO3。
(5)根据得失电子数相等,氧气与银的关系式是:O2![]() 4Ag,A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2的体积是
4Ag,A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2的体积是![]() =0.28L=280mL,因此,本题正确答案为:280
=0.28L=280mL,因此,本题正确答案为:280

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案