题目内容
7.N是重要的非金属元素,尿素、羟胺、硝酸、亚硝酸钠均为重要的含氮化合物.(1)尿素[CO(NH2)2]是人类利用无机物合成的第一种有机物.
①尿素中元素原子半径最大的原子结构示意图为
 ;
;②尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因NH4++OH-=NH3.H2O=NH3↑+H2O;
③已知:20℃时,H2CO3:Ka1=4.2×10ˉ7、Ka2=5.6×10ˉ11;NH3•H2O:Kb=1.7×10ˉ5,碳酸氢铵溶液中HCO3ˉ、NH4+、OHˉ、H+四种离子浓度由大到小的顺序为c(NH4+)>c(HCO3-)>c(OH-)>c(H+);
(2)羟胺(NH2OH)可看做是氨分子内的1个氢原子被羟基取代的物质,常用作还原剂.
①利用羟胺的还原性,可以除去含Fe2+中的Fe3+,氧化产物是一种性质稳定、无污染的气体,写出反应的离子方程式2NH2OH+2Fe3+=2Fe2++N2↑+2H2O+2H+
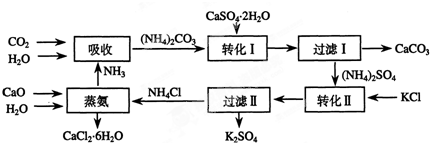
②制备NH2OH•HCl(盐酸羟胺)的一种工艺流程如图所示:

ⅰ步骤中,发生反应的化学方程式为2NH2OH+2Fe3+=2Fe2++N2↑+2H2O+2H+;
ⅱ步骤中使用的NaNO2外观酷似食盐,误食会中毒.可用电解法将工业废水中少量的NO2-转化为N2以降低其危害.写出NO2ˉ在酸性条件下转化为氮气的电极反应式为2NO2-+8H++6e-=N2+4H2O.
ⅲ步骤中,X为氯化钡(填名);若要使滤液Y中SO42ˉ、SO32ˉ浓度均小于1×10ˉ5mol/L,溶液中Ba2+浓度应不小于5.0×10-5mol/L.[已知KSP(BaSO3)=5.0×10ˉ10;KSP(BaSO4)=1.1×10ˉ10]
③用惰性电极电解硝酸溶液可制备NH2OH.写出其阳极反应式4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+
(2)某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=+Q kJ•mol-1(Q>0)达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是BC
A.产物B的状态只能为固态或液态
B.平衡时,v(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ.
分析 (1)①尿素[CO(NH2)2]中C原子半径最大;
②碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水;
③电离平衡常数越大,其电离程度越大,则其离子水解程度越小;
(2)①羟胺被氧化生成氮气;
②i二氧化硫和氢氧化钙反应生成盐和水;
ii电解时,得电子的微粒在阴极上发生还原反应,电解亚硝酸根离子溶液时,阴极上亚硝酸根离子得电子发生还原反应生成氮气和水;
ⅲ由转化前后的物质可知,生成物中引入钡离子和氯离子;Y中SO42ˉ、SO32ˉ浓度均小于1×10ˉ5mol/L,以KSP(BaSO3)计算;
③用惰性电极电解硝酸溶液可制备NH2OH,阳极上氢氧根离子失去电子,阴极上N得到电子;
(3)A、若B为气体,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗;
C、依据A分析可知B为非气体,加入B平衡不动;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时不能完全消耗,放出热量小于Q
解答 解:(1)①原子的电子层数越多,其原子半径越大,相同周期的元素中,原子半径随着原子序数的增大而减小,所以原子半径最大的元素是C元素,其原子结构示意图为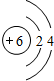 ,
,
故答案为: ;
;
②碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水,所以其离子方程式为:NH4++OH-=NH3.H2O=NH3↑+H2O,
故答案为:NH4++OH-=NH3.H2O=NH3↑+H2O;
③电离平衡常数越大,其电离程度越大,则其离子水解程度越小,根据电离平衡常数知,电离程度大小关系是NH3•H2O>H2CO3>HCO3-,则水解程度CO32->HCO3->NH4+,所以碳酸氢铵溶液呈碱性,溶液中还存在碳酸根离子等,所以HCO-3、NH+4、OH-、H+四种离子浓度由大到小c(NH4+)>c(HCO3-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(HCO3-)>c(OH-)>c(H+);
(2)①羟胺被氧化生成氮气和水,反应的离子方程式为2NH2OH+2Fe3+=2Fe2++N2↑+2H2O+2H+,
故答案为:2NH2OH+2Fe3+=2Fe2++N2↑+2H2O+2H+;
②i二氧化硫和氢氧化钙反应生成盐和水,反应化学方程式:Ca(OH)2+2SO2=Ca(HSO3)2,
故答案为:Ca(OH)2+2SO2=Ca(HSO3)2;
ⅱ电解时,得电子的微粒在阴极上发生还原反应,电解亚硝酸根离子溶液时,阴极上亚硝酸根离子得电子发生还原反应生成氮气和水,电极反应式为2NO2-+8H++6e-=N2↑+4H2O,
故答案为:2NO2-+8H++6e-=N2+4H2O;
ⅲ由转化前后的物质可知,生成物中引入钡离子和氯离子,则X为BaCl2;Y中SO42ˉ、SO32ˉ浓度均小于1×10ˉ5mol/L,溶液中Ba2+浓度应不小于$\frac{5.0×1{0}^{-10}}{1×1{0}^{-5}}$=5.0×10-5mol/L,
故答案为:氯化钡;5.0×10-5mol/L;
③用惰性电极电解硝酸溶液可制备NH2OH,阳极上氢氧根离子失去电子,阳极反应式为4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+,
故答案为:4OH--4e-=O2↑+2H2O或2H2O-4e-=O2↑+4H+;
(3)达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等;
A、若B为气体,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变;若B是非气体,平衡常数K=c(C),由于C(g)的浓度不变,因此B可以是气体或是非气体,故A错误;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗,C浓度不变,故B正确;
C、保持体积不变,B可以是气体或是非气体,则向平衡体系中加入B,平衡可能不移动,也可能逆向进行,故C正确;
D、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时转化率一定小于100%,因此放出热量小于Q,故D错误;
故选BC.
点评 本题考查较综合,涉及离子浓度大小比较、溶度积的计算、电解、氧化还原反应等,注重高频考点的考查,综合性较强,题目难度中等.

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案| A. | 硫酸铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 少量Ca(OH)2溶液与大量NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 盐酸中滴入Na2CO3溶液:2H++CO32-═CO2↑+H2O |
| A. | 含有一个双键的链状有机物 | B. | 含有三个双键的链状有机物 | ||
| C. | 含有一个双键的环状有机物 | D. | 含有一个三键的链状有机物 |
| A. | 从海带中提取溴单质的过程涉及氧化还原反应 | |
| B. | 通常泉水、深井水等地下水硬度比河水等地表水大 | |
| C. | 赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的 | |
| D. | 实践证明,喝硬度大的水会引起肠胃不适,所以饮用水硬度越小越好 |
| A. | 100 mL 0.5 mol/L MgCl2溶液 | B. | 200 mL 0.25 mol/L AlCl3溶液 | ||
| C. | 50 ml 1 mol/L NaCl溶液 | D. | 50 ml 0.5 mol/L HCl溶液 |