题目内容
16.下列说法不正确的是( )| A. | 从海带中提取溴单质的过程涉及氧化还原反应 | |
| B. | 通常泉水、深井水等地下水硬度比河水等地表水大 | |
| C. | 赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的 | |
| D. | 实践证明,喝硬度大的水会引起肠胃不适,所以饮用水硬度越小越好 |
分析 A.海水提溴是先氧化溴离子为溴单质,再用还原剂还原溴单质为溴离子,再用氧化剂氧化溴离子为溴单质;
B.泉水、深井水等地下水溶有较多的矿物质;
C.赤潮是在特定的环境条件下,海水中某些浮游植物、原生动物或细菌爆发性增殖或高度聚集而引起水体色的一种有害生态现象,是由工农业生产和生活废水引起沿海水域的富营养化而造成的;
D.通过饮用水,可获取人体所需要的微量元素.
解答 解:A.海水提溴是先氧化溴离子为溴单质,再用还原剂还原溴单质为溴离子,再用氧化剂氧化溴离子为溴单质,涉及氧化还原反应,故A正确;
B.泉水、深井水等地下水溶有较多的矿物质,溶解的矿物质种类和数量也比较多,故通常泉水、深井水等地下水硬度比河水等地表水大,故B正确;
C.赤潮是在特定的环境条件下,海水中某些浮游植物、原生动物或细菌爆发性增殖或高度聚集而引起水体色的一种有害生态现象,是由工农业生产和生活废水引起沿海水域的富营养化而造成的,故C正确;
D.通过饮用水,可获取人体所需要的微量元素,不能长期饮用硬度较小的水,如饮用蒸馏水,则不利用人体健康,故D错误;
故选:D.
点评 本题为综合题,考查了环境的污染与防治、海水提溴、硬水的软化以及人体健康的知识,侧重考查与生活相关的化学知识,题目难度不大.

练习册系列答案
相关题目
6.下列各组离子能在强酸性的溶液中大量共存,且溶液呈无色的是( )
| A. | K+、Na+、MnO4-、SO42- | B. | K+、Na+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、NO3- | D. | Ba2+、K+、OH-、SO42- |
4.分子式为 C8H10的苯的同系物,其苯环上的一氯代物的种类有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
11.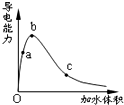 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )| A. | a、b、c三点溶液的pH:c<a<b | |
| B. | a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b | |
| C. | a、b、c三点中b点n(H+)最大 | |
| D. | a、b、c三点醋酸的电离程度:a<b<c |
1.C4H10O中既能发生消去反应又能发生催化氧化的醇类的同分异构体数目为( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
8.下列关于金属腐蚀与防护的说法正确的是( )
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 铝制品的耐腐蚀性强,说明铝的化学性质不活泼 | |
| C. | 将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀 | |
| D. | 钢铁锈蚀时,铁失去电子成为Fe3+,而后生成Fe(OH)3,再部分脱水成为氧化铁的水合物 |
5. 科学家最近合成了一种烃,根据分析,绘制出了该烃分子的球棍模型(如图),关于该烃的下列说法正确的是( )
科学家最近合成了一种烃,根据分析,绘制出了该烃分子的球棍模型(如图),关于该烃的下列说法正确的是( )
 科学家最近合成了一种烃,根据分析,绘制出了该烃分子的球棍模型(如图),关于该烃的下列说法正确的是( )
科学家最近合成了一种烃,根据分析,绘制出了该烃分子的球棍模型(如图),关于该烃的下列说法正确的是( )| A. | 分子中碳原子所处的位置都相同 | |
| B. | 该烃分子中含有极性键,故易溶于水 | |
| C. | 该烃的一卤代物只有一种结构 | |
| D. | 分子中只有C-C单键,没有C=C双键 |
6.有些化学反应反应速率很慢且副反应较多,测定这些反应的焓变可运用( )
| A. | 盖斯定律 | B. | 勒夏特列原理 | C. | 阿伏加德罗定律 | D. | 质量守恒定律 |
 ;
;