题目内容
【题目】(14分)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定某补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)步骤②中加入足量NaOH发生的主要反应的离子方程式为 ,
步骤③中反应的化学方程式为 。
(2)步骤④中一系列处理的操作步骤: 、洗涤、 、冷却、称量。
(3)若实验中需用98%的浓硫酸(密度为1.84g/mL)配制1 mol/L的稀硫酸480 mL。配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有 ,需用量筒量取该浓硫酸 mL。
(4)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
【答案】(14分,每空2分)
(1)Fe2++2OH--=Fe(OH)2↓
4Fe(OH)2 + O2 + 2H2O=4Fe(OH)3
(2)过滤 灼烧
(3)500mL容量瓶(不答容量瓶的规格得1分) 27.2mL
(4)0.07a
【解析】
试题根据工艺流程可推断,补血剂药片的成分是FeSO4·7H2O,研细后加入稀硫酸,不反应但会抑制Fe2+的水解防止溶液变浑浊,过滤得到不溶性物质和硫酸亚铁溶液,向溶液中加入氢氧化钠,然后鼓入过量空气,依次发生FeSO4 +2NaOH=Fe(OH)2↓ +Na2SO4 、4Fe(OH)2 + O2 + 2H2O=4Fe(OH)3 ,产生的红褐色悬浊液是Fe(OH)3 悬浊液,再经过过滤、洗涤、灼烧、冷却、称量等操作得到a克氧化铁固体。(1) 步骤②中加入足量NaOH发生的主要反应的离子方程式为Fe2++2OH--=Fe(OH)2↓,步骤③中反应的化学方程式为4Fe(OH)2 + O2 + 2H2O=4Fe(OH)3
(2) 步骤④中一系列处理的操作步骤:过滤、洗涤、灼烧、冷却、称量。
(3)实验室没有480mL的容量瓶,选取500mL容量瓶,配制500mL 1.0molL-1稀硫酸需要使用的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有500mL容量瓶,98%的浓硫酸(其密度为1.84g/cm3)的物质的量浓度为:c=1000×1.84×98%/98=18.4mol/L,配制500mL 1.0molL-1稀硫酸,需要浓硫酸的体积为:1.0mol/L×0.5L/18.4mol/L≈0.0272L=27.2mL。
(4)根据铁原子守恒,2Fe—2FeSO4·7H2O—Fe2O3
2 1
a/80 a/160
则每片补血剂含铁元素的质量(a/80)×56÷10=0.07a

【题目】下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是()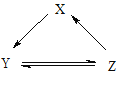
项目 | X | Y | Z |
A | Si | SiO2 | H2SiO3 |
B | Na | NaOH | NaCl |
C | NO | NO2 | HNO3 |
D | NaClO | HClO | Cl2 |
A. A B. B C. C D. D