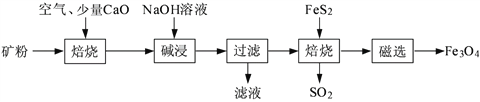
题目内容
【题目】铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含FeO、SiO2等杂质)为原料生产Cr2O3的流程如下:
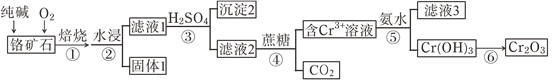
已知:主要反应是:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2
4Na2CrO4+4CO2
Cr2![]() +H2O
+H2O![]() 2Cr
2Cr![]() +2H+,Ksp[Cr(OH)3] =6.4×10-31,lg2 = 0.3
+2H+,Ksp[Cr(OH)3] =6.4×10-31,lg2 = 0.3
(1)Cr(OH)3和Al(OH)3性质类似,则Cr(OH)3与KOH反应的离子方程式为:_______;
(2)步骤⑤中为了使Cr3+完全沉淀[此时,c(Cr3+)≤10-5mol·L-1],pH至少调至_____;
(3)滤液3中的主要溶质是两种盐,化学式为_____、________;
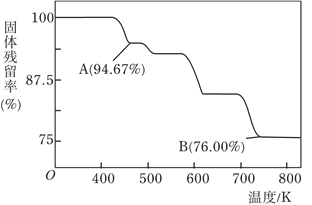
(4)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时剩余Cr的氧化物化学式为_____________。
【答案】Cr(OH)3+OH-=CrO2-+2H2O5.6(NH4)2SO4Na2SO4Cr2O3
【解析】
铬铁矿(主要成分是Cr2O3,含FeO、SiO2等杂质)加入碳酸钠煅烧,可生成Na2CrO4、Fe2O3、Na2SiO3等,加入水浸取,得到固体1为Fe2O3,过滤得滤液1为Na2CrO4、Na2SiO3等,向滤液1中加入稀硫酸调节pH得到沉淀2为H2SiO3,过滤后向滤液中加入蔗糖,用蔗糖还原,得到二氧化碳和含有Na+、Cr3+的溶液,再与氨水反应,滤液3的主要溶质是两种盐为(NH4)2SO4、Na2SO4,得到Cr(OH)3沉淀,灼烧据Cr(OH)3沉淀得到Cr2O3。
(1)Cr(OH)3和Al(OH)3性质类似,具有两性,则Cr(OH)3与KOH反应的离子方程式为:Cr(OH)3+OH-=CrO2-+2H2O;
(2)Cr3+沉淀完全的浓度为10-5mol·L-1,根据KSP[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.4×10-31,可知c(OH-)=4×10-9mol·L-1,则c(H+)=10-14/4×10-9mol·L-1=1/4×10-5mol·L-1,则pH=-lg(1/4×10-5)=5.6.步骤⑤中为了使Cr3+完全沉淀[此时,c(Cr3+)≤10-5mol·L-1],pH至少调至5.6;
(3)滤液3中的主要溶质是两种盐,化学式为(NH4)2SO4、Na2SO4;
(4)设CrO3的质量为100g,则CrO3中铬元素的质量为:100g×52/(52+16×3)=52g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为![]() =2:3,所以B点时剩余固体的成分是Cr2O3.
=2:3,所以B点时剩余固体的成分是Cr2O3.

 阅读快车系列答案
阅读快车系列答案【题目】下列关于物质分类的正确组合是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | 纯碱 | 硫酸 | 小苏打 | 氧化铝 | 干冰 |
B | 苛性钠 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
C | 熟石灰 | 冰醋酸(CH3COOH) | 胆矾CuSO4·5H2O | 三氧化硫 | 二氧化硫 |
D | 苛性钾 | HNO3 | 碳酸钙 | 生石灰 | SO3 |
A.AB.BC.CD.D