题目内容
5. 用6g CaCO3与100mL稀盐酸反应制取少量的CO2,反应过程中生成的CO2的体积(已折算为标准状况)随反应时间变化的情况如图所示.下列说法正确的是( )
用6g CaCO3与100mL稀盐酸反应制取少量的CO2,反应过程中生成的CO2的体积(已折算为标准状况)随反应时间变化的情况如图所示.下列说法正确的是( )| A. | OE段表示的平均反应速率最快,可能的原因是该反应是放热反应 | |
| B. | EF段用HC1浓度的减小表示的该反应的平均反应速率为0.2 mol/(L•min) | |
| C. | 在F点收集到的CO2的体积最大 | |
| D. | 在G点以后收集的CO2的量不再增多,原因是稀盐酸已反应完全 |
分析 A.溶液中氢离子浓度越大,反应速率越快,温度越高反应速率越快;反应速率与曲线的斜率成正比;
B.由图可知EF段生成的二氧化碳体积为672mL-224mL=448mL,n(CO2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,根据二氧化碳的物质的量计算参加反应的n(HCl),再结合反应速率公式计算;
C.曲线上点的纵坐标的值即为该点收集的二氧化碳的体积;
D.二氧化碳体积最大为784mL,n(CO2)=$\frac{0.784L}{22.4L/mol}$=0.035mol,根据C原子守恒知参加反应的n(CaCO3)=0.035mol<$\frac{6g}{100g/mol}$=0.06mol.
解答 解:A.溶液中氢离子浓度越大,反应速率越快,越高应该反应速率越快,该反应是放热反应,但刚开始时,浓度的影响大于温度的影响,反应速率与曲线的切线成正比,根据图知OE段表示的平均反应速率最快,原因是稀盐酸浓度大,故A错误;
B.由图可知EF段生成的二氧化碳体积为672mL-224mL=448mL,n(CO2)=$\frac{0.448L}{22.4L/mol}$=0.02mol,根据二氧化碳和稀盐酸的关系式得参加反应的n(HCl)=2n(CO2)=0.02mol×2=0.04mol,则HCl的平均反应速率=$\frac{\frac{0.04mol}{0.1L}}{1min}$=0.4 mol/(L•min),故B错误;
C.曲线上点的纵坐标的值即为该点收集的二氧化碳的体积,所以在G点收集到的CO2的体积最大,故C错误;
D.二氧化碳体积最大为784mL,n(CO2)=$\frac{0.784L}{22.4L/mol}$=0.035mol,根据C原子守恒知参加反应的n(CaCO3)=0.035mol<$\frac{6g}{100g/mol}$=0.06mol,说明碳酸钙有剩余,则稀盐酸完全被消耗,故D正确;
故选D.
点评 本题考查化学方程式的有关计算,侧重考查分析计算能力,知道曲线切线含义,注意D中要进行过量计算,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | 煤的干馏 | B. | 石油的分馏 | C. | 石油的裂化 | D. | 煤的气化 |
 中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )| A. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| D. | 若D是一种强酸且可与铜反应生成B或C,则A既可以是单质也可以是化合物 |
| A. | CaBr2 | B. | NaHCO3 | C. | H2 | D. | C6H6 |
| A. | 是最简单的有机化合物 | |
| B. | 在1500℃以上能比较完全地分解,生成炭黑和氢气 | |
| C. | 与等物质的量的氯气混合在光照下充分反应,生成物中HC1的物质的量最大 | |
| D. | 完全燃烧生成的CO2和H2O的物质的量之比是1:1 |
| A. | 3,4,4-三甲基-1-戊炔 | B. | 2,2-二甲基-3-丁烯 | ||
| C. | 2,3,4,4-四甲基戊烷 | D. | 1,3,4-三甲基苯 |
| A. | 一氟一氯甲烷只有一种结构,可以证明甲烷是正四面体结构 | |
| B. | 甲烷、乙烯和苯分子中所有原子都在同一个平面上 | |
| C. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| D. | 1 mol乙醇与足量的钠反应生成0.5 mol氢气,可证明乙醇分子中只有一个羟基 |
| A. | 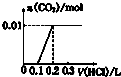 | B. | 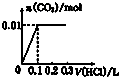 | C. | 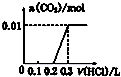 | D. | 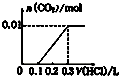 |
| A. | 氰分子中四原子共直线,是含有极性键的非极性分子 | |
| B. | 氰分子中碳氰三键键长大于乙炔中碳碳三键键长,所以氰气更容易和氢气加成 | |
| C. | 氰气能与强碱溶液反应得到氰化物和次氰酸盐 | |
| D. | 氰分子中σ键和π键的个数比为3:4 |