题目内容
【题目】某稀溶液中含有5molKNO3和2.5molH2SO4,向其中加入1.5molFe,充分反应(已知NO3-被还原为NO),最终溶液体积为1L。下列说法正确的是( )
A.所得溶液中c(NO3-)=2.75mol·L-1
B.所得溶液中c(Fe2+):c(Fe3+)=1:1
C.反应后生成NO的体积为33.6L(标准状况下)
D.所得溶液中的溶质只有FeSO4
【答案】B
【解析】
第一步反应:比例关系来看,只有H+完全反应。
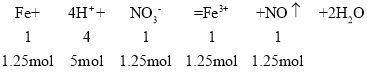
铁粉剩余1.5mol-1.25mol=0.25mol硝酸根离子剩余5mol-1.25mol=3.75mol
n(Fe3+)=1.25mol,V(NO)=n(NO)×Vm=1.25mol×22.4L/mol=28L;
第二步反应:比例关系来看,铁粉完全反应。
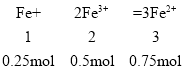
铁离子剩余:1.25mol-0.5mol=0.75mol,生成n(Fe2+)=0.75mol。
根据以上分析可知
A.所得溶液中c(NO3-)=![]() =3.75 mol·L-1,故A错误;
=3.75 mol·L-1,故A错误;
B.所得溶液中所得溶液中c(Fe2+):c(Fe3+)=![]() :
:![]() =1:1,故B正确;
=1:1,故B正确;
C.反应后生成NO的体积为V(NO)=n(NO)×Vm=1.25mol×22.4L/mol=28L (标准状况下),故C错误;
D.反应所得溶液中阳离子为铁离子、亚铁离子和钾离子,阴离子为硫酸根离子和硝酸根离子,故D错误;
答案选B。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
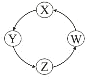
【题目】下列各组物质中,满足表中图示物质在一定条件下,一步转化关系的组合有( )
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③B.①③C.②③D.①④