题目内容
【题目】某课外小组对金属钠进行研究。已知C、D都是单质,F的水溶液是一种常见的强酸。

(1)金属Na在空气中放置足够长时间,最终的生成物是:_________________________。
(2)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_________________________。
(3)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,请写出该过程中发生氧化还原反应的化学方程式:_________________________。
(4)若A是一种溶液,只可能含有H+、NH![]() 、Mg2+、Fe3+、Al3+、CO
、Mg2+、Fe3+、Al3+、CO![]() 、SO
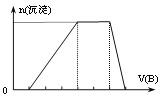
、SO![]() 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其物质的量浓度之比为_________。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其物质的量浓度之比为_________。
(5)将NaHCO3与M的混合物在密闭容器中充分加热后排出气体,经测定,所得固体为纯净物,则NaHCO3与M的质量比为____________。
【答案】碳酸钠 或Na2CO3 溶液中逐渐有白色絮状沉淀生成且不断增加;然后又由多到少最后沉淀消失。 4Fe(OH)2+O2+2H2O==4Fe(OH)3 c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3 ≥84:39
【解析】
由转化关系图可知,M为Na2O2,C、D都是单质,Na与水反应生成C,则C为H2,B为NaOH,F的水溶液是一种常见的强酸,则F为HCl,D为Cl2,若A是一种常见金属单质,则A为Al,E为NaAlO2,G为NaCl;若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则A为FeCl2,E为Fe(OH)3;若A是一种溶液,由图可知,开始发生酸碱中和,然后Al3+与碱反应,再NH4+与碱反应,最后沉淀与碱反应完全溶解,然后结合物质的性质及反应来解答。
(1)Na在空气中放置足够长时间,发生4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO310H2O、Na2CO310H2O=Na2CO3+10H2O,则最终生成物为碳酸钠或Na2CO3;答案为碳酸钠或Na2CO3。
(2)若A是一种常见金属单质,则A为Al,E为NaAlO2,G为NaCl,将过量的F溶液逐滴加入E溶液,边加边振荡,发生NaAlO2+HCl+H2O=NaCl+Al(OH)3↓、Al(OH)3+3HCl=AlCl3+3H2O,所看到的实验现象是:溶液中逐渐有白色絮状沉淀生成且不断增加,然后又由多到少最后沉淀消失;答案为:溶液中逐渐有白色絮状沉淀生成且不断增加,然后又由多到少最后沉淀消失。
(3)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则A为FeCl2,E为Fe(OH)3,则A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,该过程中发生氧化还原反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;答案为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)若A是一种溶液,由图可知,开始发生酸碱中和,然后Al3+与碱反应,再NH4+与碱反应,最后沉淀与碱反应完全溶解,则溶液中不存在Fe3+、Mg2+,有H+和Al3+,不存在CO32-,因而该溶液中含H+、NH4+、Al3+,由离子共存及电荷守恒可知,还存在的阴离子为SO42-,由消耗B的体积可知,c(H+):c(Al3+):c(NH4+)=1:1:2,由电荷守恒可知c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3;答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3。
(5)由2NaHCO3![]() Na2CO3+CO2↑+H2O、2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑、CO2+2NaOH=Na2CO3+H2O可知,充分加热后排出气体,经测定,所得固体为纯净物,则生成物只有Na2CO3,即n(NaHCO3):n(Na2O2) ≥2:1,NaHCO3与M的质量比为≥84:39;答案为≥84:39。
Na2CO3+CO2↑+H2O、2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑、CO2+2NaOH=Na2CO3+H2O可知,充分加热后排出气体,经测定,所得固体为纯净物,则生成物只有Na2CO3,即n(NaHCO3):n(Na2O2) ≥2:1,NaHCO3与M的质量比为≥84:39;答案为≥84:39。