题目内容
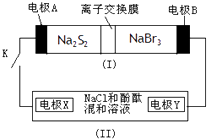
【题目】某无色溶液X中,可能含有Na+、Cu2+、Mg2+、Al3+、SiO32﹣、AlO2﹣、CO32﹣、Cl﹣中的一种或几种.现取该溶液适量,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示,下列说法中不正确的是( ) 
A.溶液X中一定不含Cu2+、Mg2+、Al3+ , 可能含有Cl﹣
B.OA段参加反应的阴离子的物质的量之比为2:1或1:2
C.AB段一定生成了气体
D.BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O
【答案】B
【解析】解:溶液呈无色,说明不含有色离子Cu2+ , 加入稀盐酸时先不生成沉淀,说明溶液中含有先和盐酸反应的离子,AB段加入稀盐酸时不生成沉淀,BC段加入稀盐酸沉淀减少,说明生成的沉淀能和稀盐酸反应生成可溶性物质,CD段加入稀盐酸沉淀不减少,说明含有不溶于稀盐酸的沉淀,则应该含有SiO32﹣;BC段说明含有AlO2﹣ , 溶于中含有SiO32﹣、AlO2﹣ , 说明溶液中不含Mg2+、Al3+ , 根据电荷守恒知,溶液中一定含有Na+ , 根据图知溶液中还含有CO32﹣ , 根据实验现象无法确定是否含有Cl﹣ , A.通过以上分析知,溶液X中一定不含Cu2+、Mg2+、Al3+ , 可能含有Cl﹣ , 故A正确;
B.OA段参加反应的阴离子有SiO32﹣、AlO2﹣ , 因为加入稀盐酸体积未知无法计算两种离子物质的量之比,故B错误;
C.AB段是碳酸氢根离子和氢离子反应生成二氧化碳和水,所以一定生成气体,故C正确;
D.BC段是氢氧化铝和稀盐酸的反应,离子方程式为Al(OH)3+3H+=Al3++3H2O,故D正确;
故选B.

 阅读快车系列答案
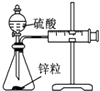
阅读快车系列答案【题目】用下列实验装置进行相应的实验,不能达到实验目的是( )
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
A.A
B.B
C.C
D.D