题目内容
【题目】X、Y是元素周期表前20号元素,且X的原子序数比Y大4.
(1)若X的氧化物、氯化物都是实验室常用的干燥剂.
(i)含有X元素的一种盐溶液和Y的一种气态氧化物均是工农业生产中常见的漂白剂,则等物质的量的二者在水溶液中发生反应的化学方程式为
(ii)酸性土壤改变会施用X的一种气态氧化物,但不能与氮肥同时施用,原因为
(2)若X是金属性最强的短周期元素
(i)单质X着火,可用来灭火.
(ii)Y与氢元素能形成一种摩尔质量为43g/mol的共价化合物,已知该物质受到撞击即可放出大量的气体,写出对应的化学方程式:
(3)若X的离子半径是第三周期离子半径最小的
Y与钙元素形成的化合物的电子式为;Y2与NaOH溶液反应的产物之一是OY2 , 该反应的离子方程式为 .
【答案】
(1)SO2+H2O+Ca(ClO)2=CaSO4↓+HClO+HCl;CaO遇水生成碱,铵态氮肥会与碱反应生成NH3 , 而降低肥效
(2)沙子;2HN3 ![]() H2↑+3N2↑
H2↑+3N2↑
(3)![]() ;2F2+2OH﹣=OF2↑+2F﹣+H2O
;2F2+2OH﹣=OF2↑+2F﹣+H2O
【解析】解:(1)若X的氧化物、氯化物都是实验室常用的干燥剂,则X为Ca,X的原子序数比Y大4,可知Y为S,(i)含有X元素的一种盐溶液和Y的一种气态氧化物均是工农业生产中常见的漂白剂,分别为Ca(ClO)2、SO2 , 二者发生氧化还原反应,反应的化学方程式为SO2+H2O+Ca(ClO)2=CaSO4↓+HClO+HCl,所以答案是:SO2+H2O+Ca(ClO)2=CaSO4↓+HClO+HCl;(ii)酸性土壤改变会施用X的一种气态氧化物,但不能与氮肥同时施用,原因是CaO遇水生成碱,铵态氮肥会与碱反应生成NH3 , 而降低肥效,
所以答案是:CaO遇水生成碱,铵态氮肥会与碱反应生成NH3 , 而降低肥效;(2)若X是金属性最强的短周期元素,应为Na,则Y为N元素,(i)钠性质活泼,易与水、氧气反应,与氧气反应生成过氧化钠,过氧化钠和与二氧化碳反应,则钠着火应用沙土扑灭,所以答案是:沙子;(ii)Y与氢元素能形成一种摩尔质量为43g/mol的共价化合物,已知该物质受到撞击即可放出大量的气体,则应为HN3 , 撞击时发生反应的化学方程式为2HN3 ![]() H2↑+3N2↑,
H2↑+3N2↑,
所以答案是:2HN3 ![]() H2↑+3N2↑;(3)若X的离子半径是第三周期离子半径最小的,应为Al,则Y为F元素, Y与钙元素形成的化合物为氟化钙,电子式为
H2↑+3N2↑;(3)若X的离子半径是第三周期离子半径最小的,应为Al,则Y为F元素, Y与钙元素形成的化合物为氟化钙,电子式为 ![]() ;F2与NaOH溶液反应的产物之一是OF2 , 该反应的离子方程式为2F2+2OH﹣=OF2↑+2F﹣+H2O,
;F2与NaOH溶液反应的产物之一是OF2 , 该反应的离子方程式为2F2+2OH﹣=OF2↑+2F﹣+H2O,
所以答案是: ![]() ;2F2+2OH﹣=OF2↑+2F﹣+H2O.
;2F2+2OH﹣=OF2↑+2F﹣+H2O.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)D(g)+E(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的物质的量如下表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T1℃时,该反应的平衡常数K=;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2molB、0.1molD,0.1molE
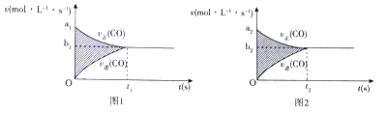
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为如图中的(填序号) 
(4)维持容器的体积和温度T1不变,当向该容器中加入1.60molB,0.20molD,0.20molE和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n取值范围mol.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= .
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图所示由图可知,Q0(填“大于”或“小于”),c点v正v逆(填“大于”、“小于”或“等于”.)