题目内容
碳酸铜和碱式碳酸铜[Cu2(OH)2CO3]均可溶于盐酸转化为氯化铜.在高温下这两种化合物均能分解生成氧化铜.溶解28.4g 的上述混合物,恰好消耗1.0mol?L-1盐酸 500mL.灼烧等量的上述混合物,得到的氧化铜质量是( )A.15g
B.30g
C.20g
D.35g
【答案】分析:根据氯元素守恒计算混合物中含有Cu的物质的量,则可求得反应反应后生成CuO的物质的量,进而求得氧化铜的质量.
解答:解:碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜,消耗1mol/L盐酸500mL,盐酸溶质的物质的量为0.5mol,则CuCl2为0.25mol,
根据Cu元素质量守恒,则可知原混合物中含有0.25molCu,灼烧等质量的上述混合物,得到氧化铜的物质的量为0.25mol,则质量为0.25mol×80g/mol=20g,
故选C.
点评:本题的关键在于利用守恒思想,混合物溶于盐酸后溶质成分是CuCl2,根据氯守恒可得.
解答:解:碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜,消耗1mol/L盐酸500mL,盐酸溶质的物质的量为0.5mol,则CuCl2为0.25mol,
根据Cu元素质量守恒,则可知原混合物中含有0.25molCu,灼烧等质量的上述混合物,得到氧化铜的物质的量为0.25mol,则质量为0.25mol×80g/mol=20g,
故选C.
点评:本题的关键在于利用守恒思想,混合物溶于盐酸后溶质成分是CuCl2,根据氯守恒可得.

练习册系列答案
相关题目

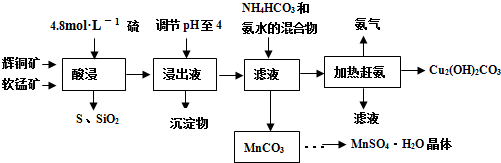
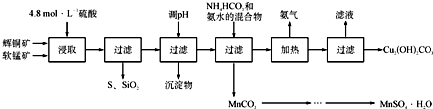
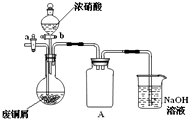 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: