题目内容
碱式碳酸铜[Cu2(OH)2CO3]是孔雀石的主要成分,加热时可分解为氧化铜、二氧化碳和水三种氧化物.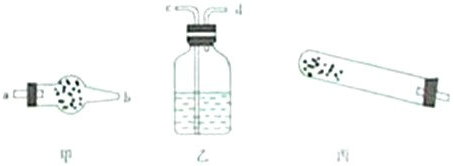
(1)若用如图所示仪器对分解产物中的非固体氧化物进行验证.则碱式碳酸铜应该放在
(2)将碱式碳酸铜与过量的木炭混合加热,可能得到铜、一氧化碳和水三种物质,该反应的化学方程式是
(3)铜及其合金用途广泛,常见的铜的合金有黄铜(铜锌合金)、青铜(铜锡合金).现有w g黄铜样品,放入足量的橘盐酸中,产生V mL气体(标准状况下),则样品中铜和锌的物质的量之比是
(用含m、V的代数式表示).

(1)若用如图所示仪器对分解产物中的非固体氧化物进行验证.则碱式碳酸铜应该放在
丙
丙
中(填甲、乙、丙),且还需使用的玻璃仪器是酒精灯
酒精灯
.(2)将碱式碳酸铜与过量的木炭混合加热,可能得到铜、一氧化碳和水三种物质,该反应的化学方程式是
4C+Cu2(OH)2CO3
2Cu+4CO↑+H20↑
| ||
4C+Cu2(OH)2CO3
2Cu+4CO↑+H20↑
.
| ||
(3)铜及其合金用途广泛,常见的铜的合金有黄铜(铜锌合金)、青铜(铜锡合金).现有w g黄铜样品,放入足量的橘盐酸中,产生V mL气体(标准状况下),则样品中铜和锌的物质的量之比是
| 22400w-65V |
| 64V |
| 22400w-65V |
| 64V |
分析:(1)丙装置可以用来加热分解固体的装置,碱式碳酸铜分解需要加热,用到酒精灯;
(2)反应物是碳和碱式碳酸铜,产物是铜、一氧化氮和水,将碱式碳酸铜化合价变化看做整体,根据化合价升降法配平;
(3)先根据氢气的体积算出锌的物质的量,然后利用黄铜质量w计算出物质的量之比.
(2)反应物是碳和碱式碳酸铜,产物是铜、一氧化氮和水,将碱式碳酸铜化合价变化看做整体,根据化合价升降法配平;
(3)先根据氢气的体积算出锌的物质的量,然后利用黄铜质量w计算出物质的量之比.
解答:解:(1)碱式碳酸铜应该放在丙装置中,还缺少加热的仪器酒精灯,
故答案为:丙;酒精灯;
(2)把碱式碳酸铜中C和Cu元素化合价变化看成整体,化合价总降低:2×(2-0)+(4-2)=6价,碳单质化合价升高2价,故碳的计量数是3,碱式碳酸铜的化学计量数是1
配平反应方程式:3C+Cu2(OH)2CO3
2Cu+4CO↑+H20↑,
故答案为:4C+Cu2(OH)2CO3
2Cu+4CO↑+H20↑;
(3)根据Zn~H2 的关系式,n(Zn)=n(H2 )=
mol,黄铜中锌的质量是:
g,铜的质量为:w-
(g),n(Cu)=
(mol),
所以样品中铜和锌的物质的量之比是:)
mol:
mol=
,
故答案为:
.
故答案为:丙;酒精灯;
(2)把碱式碳酸铜中C和Cu元素化合价变化看成整体,化合价总降低:2×(2-0)+(4-2)=6价,碳单质化合价升高2价,故碳的计量数是3,碱式碳酸铜的化学计量数是1
配平反应方程式:3C+Cu2(OH)2CO3
| ||
故答案为:4C+Cu2(OH)2CO3
| ||
(3)根据Zn~H2 的关系式,n(Zn)=n(H2 )=
| V |
| 22400 |
| 65V |
| 22400 |
| 65V |
| 22400 |
w-
| ||
| 64 |
所以样品中铜和锌的物质的量之比是:)
w-
| ||
| 64 |
| V |
| 22400 |
| 22400w-65V |
| 64V |
故答案为:
| 22400w-65V |
| 64V |
点评:本题考查了碱式碳酸铜的性质,涉及了化学方程式的书写、反应装置选择等知识,本题难度中等.

练习册系列答案
相关题目
 铁、铜和铝是人类生活中常用的金属.
铁、铜和铝是人类生活中常用的金属.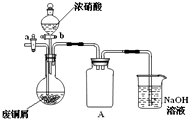 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: