题目内容
反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )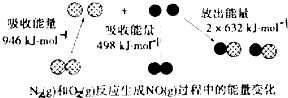
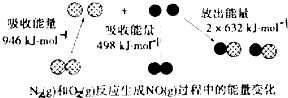
| A、通常情况下,N2(g)和O2(g)混合能直接生成NO |
| B、1mol N2(g)和NA个O2(g)反应放出的能量为180kJ |
| C、NO是一种酸性氧化,能与NaOH溶液反应生成盐和水 |
| D、1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量 |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:A.氮气和氧气在放电条件才能反应;
B.根据反应热=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算判断;
C.NO是不成盐氧化物;
D.结合B中计算的反应热进行解答.
B.根据反应热=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算判断;
C.NO是不成盐氧化物;
D.结合B中计算的反应热进行解答.
解答:
解:A.通常情况下,N2(g)和O2(g)混合不能直接生成NO,需要放电条件,故A错误;
B.N2+O2═2NO的反应热△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,反应是吸热反应,所以吸收的能量为180kJ,故B错误;
C.NO是不成盐氧化物,不能与NaOH溶液反应生成盐和水,故C错误;
D.由B中计算可知,反应N2(g)+O2(g)=2NO(g)的反应热△H=+180kJ/mol,反应是吸热反应,依据能量守恒,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故D正确;
故选D.
B.N2+O2═2NO的反应热△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,反应是吸热反应,所以吸收的能量为180kJ,故B错误;
C.NO是不成盐氧化物,不能与NaOH溶液反应生成盐和水,故C错误;
D.由B中计算可知,反应N2(g)+O2(g)=2NO(g)的反应热△H=+180kJ/mol,反应是吸热反应,依据能量守恒,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故D正确;
故选D.
点评:本题考查了反应能量变化的计算和判断,反应的焓变计算方法和能量守恒是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
LiH是一种氢气发生剂,用于军事或其他需氢气的场合.反应为:LiH+H2O→LiOH+H2↑在这个反应中( )
| A、是非氧化还原反应 |
| B、每1摩尔LiH参与反应,电子转移2摩尔 |
| C、H2既是氧化产物,又是还原产物 |
| D、LiH既是氧化剂,又是还原剂 |
第85号元素砹(At)是核电荷数最大的卤素,下列关于砹及其化合物的叙述中正确的是( )
| A、At2可能是一种有色固体,难溶于水,易溶于有机溶剂 |
| B、AgAt见光易分解,是一种能溶于水的有色固体 |
| C、相同条件下,HAt比HI更稳定 |
| D、由KAt的水溶液制备砹的化学方程式为:2KAt+Cl2→2KCl+At2 |
有A、B、C、D四种常见物质,其转化关系符合如图.则A和D不可能是( )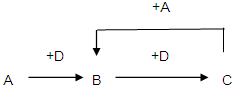

| A、C和O2 |
| B、NaOH溶液和SO2 |
| C、Fe和Cl2 |
| D、NaAlO2溶液和盐酸 |
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
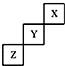

| A、X、Y、Z三种元素中,单质在常温下均为气态 |
| B、Z的氢化物的稳定性比Y的强 |
| C、Y的最高正化合价为+5 |
| D、Y的单质的熔点比Z的低 |
下列物质不能使湿润的有色布条褪色的是( )
| A、氯水 | B、氯气 |
| C、次氯酸溶液 | D、氯化钙溶液 |
盛装无水乙醇的试剂瓶上贴有的标识是( )
A、 |
B、 |
C、 |
D、 |
下列反应的离子方程式书写正确的是( )
A、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+2HCO
| ||
| B、氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O | ||
C、向亚硫酸钠溶液中加入足量硝酸:SO
| ||
| D、铜溶解于氯化铁溶液中:2Fe3++Cu═2Fe2++Cu2+ |
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量)( )


| A、反应Ⅰ:△H>0,P2>P1 |
| B、反应Ⅱ:△H>0,T1>T2 |
| C、反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 |
| D、反应Ⅳ:△H<0,T2>T1 |