题目内容
20.某单质能跟浓HNO3反应,若参与反应的单质与硝酸的物质的量之比为1:4,则该元素在反应中所显示的化合价可能是( )(1)+1 (2)+2 (3)+3 (4)+4.
| A. | (1)(2)(3)(4) | B. | (1)(2) | C. | (3)(4) | D. | (2)(4) |
分析 单质和浓硝酸反应时,浓HNO3还原为NO2,如果单质是金属单质,硝酸体现酸性和氧化性,如果单质是非金属单质,硝酸只体现氧化性,根据转移电子相等进行计算.
解答 解:若为金属单质,设该金属元素的化合价是+n价,如果金属的物质的量是1mol,则没有被还原的硝酸是nmol,所以被还原的硝酸是(4-n)mol,则根据电子的得失守恒可知:n=4-n,解得n=+2;
如为非金属单质,硝酸只表现为氧化性,若参加反应的单质为1mol,消耗硝酸4mol,则根据电子的得失守恒可知:n=+4,
故选D.
点评 本题以氧化还原反应为载体考查硝酸性质,侧重考查分析计算能力,很多同学往往漏掉硝酸体现酸性作用而导致错误,为易错题.

练习册系列答案
相关题目
16.下列说法不正确的是( )
| A. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 | |
| B. | CH2=CH-CH(CH3)-C≡CH经催化加氢可生成3-甲基戊烷 | |
| C. | 当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒 | |
| D. | 已知苹果酸的结构简式为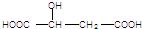 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 |
5.化学与环境、材料、信息、能源关系密切,下列说法正确的是( )
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维 |
12.为了除去硝酸钾晶体中所含的Ca(NO3)2、K2SO4、MgSO4,现将其配成溶液,然后加入K2CO3、Ba(OH)2、HNO3等试剂,通过过滤、蒸发等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序准确的是( )
| A. | HNO3、K2CO3、Ba(OH)2 | B. | Ba(OH)2、HNO3、K2CO3 | ||
| C. | K2CO3、Ba(OH)2、HNO3 | D. | Ba(OH)2、K2CO3、HNO3 |

