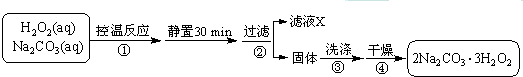
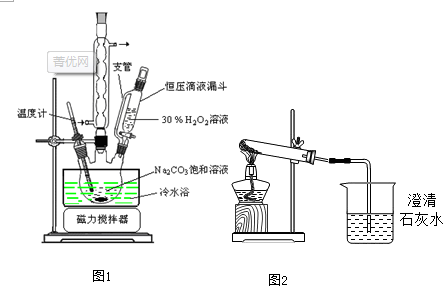
题目内容
16.比较Al和Mg这两种金属强弱性的方法是( )| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液 | |
| C. | 将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液 | |
| D. | 将空气中放置已久的这两种元素的单质分别和热水作用 |
分析 元素的金属性越强,其最高价氧化物的水化物碱性越强、其单质与水或酸反应生成氢气越容易,较活泼金属能置换出较不活泼金属,据此分析解答.
解答 解:A.金属的金属性强弱与单质的硬度和熔点无关,所以不能根据单质的硬度和熔点判断金属性强弱,故A错误;
B.在氯化铝和氯化镁的溶液中分别滴加过量的NaOH,二者都能反应,不能证明金属性强弱,故B错误;
C.镁和热水反应生成氢氧化镁和氢气且溶液呈碱性,铝和热水不反应,所以可以据此判断金属性强弱,故C正确;
D.将空气中久置的镁带和铝片分别置于热水中,由于二者表面有氧化膜,所以不与水反应,滴入酚酞溶液,均无现象,故D错误;
故选C.
点评 本题考查金属性强弱判断方法,为高频考点,金属的金属性强弱只与失电子难易程度有关,与失电子多少无关,为易错点.

练习册系列答案
相关题目
6.下列有关物质的性质或应用说法正确的是( )
| A. | 氢氧化钠用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 在AlCl3溶液中加入过量氨水最终无沉淀生成 | |
| C. | 工业上可利用钠和TiCl4溶液反应制取金属Ti | |
| D. | 锅炉中水垢可用盐酸或醋酸除去 |
7.补充表格:
| 物质 | 粒子数目 | 质量(m)(g) | 物质的量(n)(mol) | 摩尔质量(M)(g/mol) |
| 氦气(He) | 0.2 | |||
| S | 1.204×1023 | |||
| CO2 | 22 | |||
| C12H12O11 | 0.25 |
4.下列说法正确的是( )
| A. | 3.0g C2H6的中含有公用电子对的数目为0.7×6.02×1023 | |
| B. | 25℃时,pH=1的醋酸中H+含有的数目为0.1×6.02×1023 | |
| C. | 已知2CO(g)+O2(g)?2CO2(g)△H=+-a kJ•mol-1,将2 NA 个CO与 NA 个O2混合,充分反应放出a kJ的热量 | |
| D. | 50mL 18.4mol•L-1 浓硫酸与足量铜微热反应生成 SO2分子数目为0.46NA |
10.硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、Fe2O、FeO、Al2O3,、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取MgSO4•7H2O的工艺流程如下:

已知:NaClO与Mn2+反应产生MnO2沉淀.
(1)实验中需用1.00mol•L-1的硫酸80.0ml.若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、100mL容量瓶.
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、过滤洗涤.
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式[Al(OH)]2++H+=[Al(OH)]++H2O.
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为负极(填“正”或“负”).由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.


已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、过滤洗涤.
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式[Al(OH)]2++H+=[Al(OH)]++H2O.
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为负极(填“正”或“负”).由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.

7.下列叙述正确的是( )
| A. | 凡是含有离子键的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物都是共价化合物 | |
| C. | 凡是能电离出离子的化合物都是离子化合物 | |
| D. | 非金属原子间以共价键结合的物质都是共价化合物 |
8.银耳本身为淡黄色,福建省出产一种雪耳,颜色洁白如雪.其制作过程如下:将银耳堆放在密封状况良好的塑料棚内,在棚的一端置一口锅,锅内放硫磺,加热使硫磺熔化并燃烧,两天左右,雪耳就制成了.这种雪耳是对人体有害的.制作雪耳利用了( )
| A. | 硫的还原性 | B. | 硫的氧化性 | ||
| C. | 二氧化硫的还原性 | D. | 二氧化硫的漂白性 |