题目内容
4.锂离子电池的广泛应用使回收利用锂资源成为重要课题.某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉行涂覆在铝箔上)进行资源回收研究,设计实验流程如图: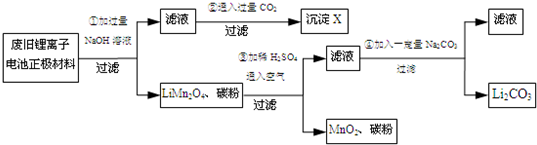
(1)第①步反应的离子方程式为:2Al+2OH-+2H2O═2Al3++3H2↑.
(2)第②步反应得到的沉淀X的化学式为Al(OH)3.
(3)第③步反应的离子方程式是4LiMn2O4+O2+4H+=4Li++8MnO2+2H2O.
(4)第④步反应后,过滤Li2CO3所需的玻璃仪器有漏斗、玻璃棒、烧杯.
分析 第①步就是铝溶解在氢氧化钠溶液中(注意LiMn2O4不溶于水)生成四羟基合铝酸钠,即滤液的主要成分,第②步就是四羟基合铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠的过程,第③步是LiMn2O4在酸性环境下能被空气中的氧气氧化发生的氧化还原反应,得到的滤液中有生成的硫酸锂,可能有过量的硫酸,最后④步加入碳酸钠之后所得的滤液主要成分为硫酸钠,
(1)第①步反应为用氢氧化钠溶液溶解铝箔,根据电荷守恒和元素守恒书写反应的离子方程式;
(2)四羟基合铝酸钠与二氧化碳反应产生氢氧化铝和碳酸氢钠;
(3)LiMn2O4在酸性环境下能被空气中的氧气氧化;
(4)根据过滤实验所需要的仪器.
解答 解:第①步就是铝溶解在氢氧化钠溶液中(注意LiMn2O4不溶于水)生成四羟基合铝酸钠,即滤液的主要成分,第②步就是四羟基合铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠的过程,第③步是LiMn2O4在酸性环境下能被空气中的氧气氧化发生的氧化还原反应,得到的滤液中有生成的硫酸锂,可能有过量的硫酸,最后④步加入碳酸钠之后所得的滤液主要成分为硫酸钠,
(1)第①步反应为用氢氧化钠溶液溶解铝箔,反应的离子方程式为2Al+2OH-+2H2O═2Al3++3H2↑,故答案为:2Al+2OH-+2H2O═2Al3++3H2↑;
(2)四羟基合铝酸钠与过量二氧化碳反应得产物是Al(OH)3沉淀和碳酸氢钠,故答案为:Al(OH)3;
(3)在酸性环境下,LiMn2O4能被空气中的氧气氧化,离子方程式为:4 LiMn2O4+O2+4H+=4Li++8MnO2+2H2O,故答案为:4 LiMn2O4+O2+4H+=4Li++8MnO2+2H2O;
(4)过滤所用玻璃仪器有:漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯.
点评 本题是一道实验和基础知识相结合的综合题,主要是混合物分离试剂作用和生成产物判断,实验基本操作等,难度中等,答题时注意元素守恒的应用及化学用语的规范表达.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案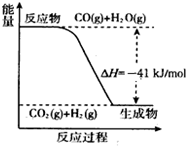 在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 |
| K | 2.6 | 1.7 | 1.0 | 0.9 |
(1)该反应的化学平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$.
(2)该反应为放热反应(填“吸热”或“放热”).
(3)增加H2O(g)的浓度,CO的转化率将增大(填“增大”、“减小”或“不变”).
(4)830℃时,向该容器中加入2molCO2与2molH2,平衡时CO2的体积分数是25%.
(5)已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.又已知2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol. 结合图象写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)?2CO2(g)△H=-566kJ/mol.
| A. | Al3+、AlO2-、NO3-、Na+ | B. | NO3-、Fe3+、Mg2+、SO42- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ba2+、Cl-、NO3- |
| A. | pH=3的H2SO4溶液中:c(H+)=10-3mol•L-1 | |
| B. | 呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 在Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 氯化铵溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| A. | 澄清石灰水中滴加少量的小苏打溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| B. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O | |
| C. | 过氧化钠和水反应:2O22-+2H2O═4OH-+O2↑ | |
| D. | H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5 H2O2+6H+═2Mn2++5O2↑+8H2O |
| 甲 | 乙 | 丙 | |
| ① | Al(OH)3 | KOH溶液 | 稀硫酸 |
| ② | SiO2 | NaOH溶液 | 氢氟酸 |
| ③ | N2 | O2 | H2 |
| ④ | Cu | FeCl3溶液 | 浓硝酸 |
| A. | ①②③④ | B. | ①②④ | C. | ①③④ | D. | ①④ |
| A. | 质量为17 g | |
| B. | 含有6.02×1023个NH3分子 | |
| C. | 标准状况下的体积为44.8 L | |
| D. | 溶于1 L水后,液中NH4+的浓度为2 mol.L-1 |
 .
. 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: