题目内容
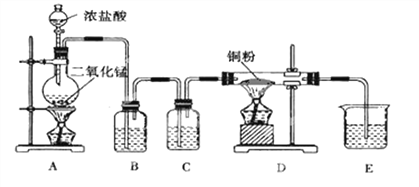
【题目】现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究.
(1)A中铁与浓硫酸发生反应的化学方程式是 , 反应中浓硫酸表现出的性质是 .
(2)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后 , 则证明装置的气密性良好.
(3)装置C的作用 .
(4)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg.铁碳合金中铁的质量分数为(写表达式).
(5)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数会偏低,原因是空气中CO2、H2O进入E管使b增大.你认为改进的方法是 .
(6)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数还会偏高.你认为其中的原因是 .
【答案】
(1)2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O;酸性和氧化性
Fe2(SO4)3+3SO2↑+6H2O;酸性和氧化性
(2)把导管放入盛有水的水槽中,微热烧瓶,如果导管口有气泡产生,停止加热后导管,产生一段水柱
(3)除去CO2中的SO2
(4)![]() ×100%
×100%
(5)E装置后再连接一个盛碱石灰的干燥管
(6)反应产生的CO2气体未能完全排到装置E中,导致b偏低
【解析】解:(1)铁和浓硫酸加热反应生成硫酸铁、二氧化硫和水,反应的化学方程式为:2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O,在该反应中部分硫元素从+6价降为+4价,同时生成硫酸铁,所以硫酸表现出的性质是酸性和氧化性;
Fe2(SO4)3+3SO2↑+6H2O,在该反应中部分硫元素从+6价降为+4价,同时生成硫酸铁,所以硫酸表现出的性质是酸性和氧化性;
所以答案是:2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O;酸性和氧化性;(2)关闭分液漏斗的活塞,在E装置后面连上一根导管,然后把最后导气管插入水,加热发生装置导气管冒气泡,停止加热上升一段水柱证明装置气密性好;
Fe2(SO4)3+3SO2↑+6H2O;酸性和氧化性;(2)关闭分液漏斗的活塞,在E装置后面连上一根导管,然后把最后导气管插入水,加热发生装置导气管冒气泡,停止加热上升一段水柱证明装置气密性好;
所以答案是:把导管放入盛有水的水槽中,微热烧瓶,如果导管口有气泡产生,停止加热后导管,产生一段水柱;(3)装置C是利用高锰酸钾溶液的强氧化性吸收二氧化硫,5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4 ;
所以答案是:除去CO2中的SO2;(4)称取ag铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则ag铁碳合金中含碳元素的质量为 ![]() =
= ![]() g,则含铁的质量为ag﹣
g,则含铁的质量为ag﹣ ![]() g,铁的质量分数为
g,铁的质量分数为 ![]() ×100%;
×100%;
所以答案是: ![]() ×100%;(5)E中所装试剂为碱石灰,可吸收空气中CO2、H2O使b增大,改进的方法是增加一个盛碱石灰的干燥管防止空气中的二氧化碳和水进入;
×100%;(5)E中所装试剂为碱石灰,可吸收空气中CO2、H2O使b增大,改进的方法是增加一个盛碱石灰的干燥管防止空气中的二氧化碳和水进入;
所以答案是:E装置后再连接一个盛碱石灰的干燥管;(6)装置中生成的二氧化碳不能全部被碱石灰吸收会导致测定结果偏低,
所以答案是:反应产生的CO2气体未能完全排到装置E中,导致b偏低.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案