��Ŀ����
����Ŀ���ã�nO2��Ũ������ȡ�������������������������ͭ�۷�Ӧ��ȡ��������ˮCuCl2��װ����ͼ��ʾ��
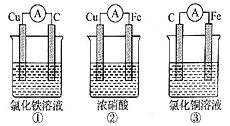
��ش�����������
��1��B��ѡ�õ��Լ��DZ���ʳ��ˮ����������_____��C��ѡ�õ��Լ���________����������_____________��
��2��D�з�Ӧ�Ļ�ѧ����ʽ��__________��������������������ˮ���õ�_____ɫ��Һ��
��3��ijѧ��Ӧ����ͼ��ʾ�ķ����о����ʵ����ʣ���������X����Ҫ�ɷ��������������ǿ�����ˮ�������ش��������⣺
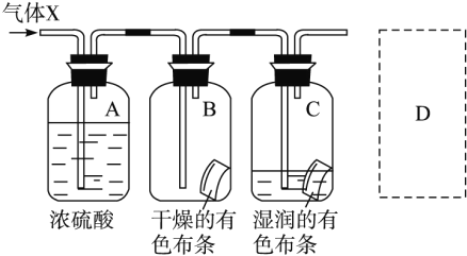
�������о�(ʵ��)����ҪĿ����_________________________________________��
�����о�Ŀ��ֱ����ص�ʵ��������_____________��
�����������ʵķ���������������ʵ����ƻ������¹��������¹ʱ�����__________��
������ͼ�е�D����ͼ����ʽ�����˷��¹������Ĵ�ʩ��_____________
���𰸡� �����Ȼ��� Ũ���� ��ˮ Cu+Cl2![]() CuCl2 �� �Ƚ�Cl2��HClO˭��Ư����(��������) B�еIJ�������ɫ��C�еIJ�����ɫ Cl2��Ⱦ����
CuCl2 �� �Ƚ�Cl2��HClO˭��Ư����(��������) B�еIJ�������ɫ��C�еIJ�����ɫ Cl2��Ⱦ���� 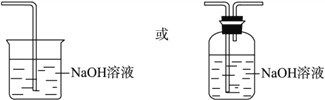
����������1��B��ѡ�õ��Լ��DZ���ʳ��ˮ���������ɵ������к����Ȼ��⣬�����������������Ȼ��⣻��ͭ��Ӧ�����������Ǹ���ģ���C��ѡ�õ��Լ���Ũ���ᣬ����������ˮ������������2��D�з�Ӧ�Ļ�ѧ����ʽ��Cu+Cl2![]() CuCl2��������������������ˮ���õ���ɫ��Һ����3������B��C��֪��Ա����ã����ʵ���Ŀ��Ϊ�Ƚ�Cl2��HClO˭��Ư���ԣ���Ũ���������ˮ�ԣ�������Ϊ���������е�ˮ�����������������������������Ư���ԣ������о�Ŀ��ֱ����ص�ʵ��������B�еIJ�������ɫ��C�еIJ�����ɫ���۴��������ʵķ���������������ʵ����ƻ������¹��������¹ʱ����������ж����ŷŵ������У���Ⱦ��������ͼ�е�D����ͼ����ʽ�����˷��¹������Ĵ�ʩ��Ӧ����β�����������������ŷŵ������У�Ӧ��β������װ�ã�
CuCl2��������������������ˮ���õ���ɫ��Һ����3������B��C��֪��Ա����ã����ʵ���Ŀ��Ϊ�Ƚ�Cl2��HClO˭��Ư���ԣ���Ũ���������ˮ�ԣ�������Ϊ���������е�ˮ�����������������������������Ư���ԣ������о�Ŀ��ֱ����ص�ʵ��������B�еIJ�������ɫ��C�еIJ�����ɫ���۴��������ʵķ���������������ʵ����ƻ������¹��������¹ʱ����������ж����ŷŵ������У���Ⱦ��������ͼ�е�D����ͼ����ʽ�����˷��¹������Ĵ�ʩ��Ӧ����β�����������������ŷŵ������У�Ӧ��β������װ�ã� ��
��

����Ŀ�������飨C8H10�����������ϵ��屽��ϩ��C8H8�����䷴Ӧԭ����C8H10��g��C8H8��g��+H2��g����H��0 ��ij�¶��£���0.40mol�����飬����2L����ܱ������з�����Ӧ���ⶨ��ͬʱ������������ʵ������õ��������±���
ʱ��/min | 0 | 10 | 20 | 30 | 40 |
n��C8H10��/mol | 0.40 | 0.30 | 0.26 | n2[��Դ��] | n3 |
n��C8H8��/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
��1������Ӧ���е�20minʱ���ö�ʱ����H2��ƽ����Ӧ������ ��
��2�����¶��£��÷�Ӧ�Ļ�ѧƽ�ⳣ���� ��
��ѧ�� | C��H | C��C | C=C | H��H |
����/kJmol1 | 412.5 | 348 | 612 | 436 |
��3����֪�� ����������Ӧ�ġ�H=kJmol��1 �� �����������������䣬��0.40mol H2��g����0.40mol C8H8��g���ϳ�C8H10��g��������30kJ�����ų�ʱ���÷�Ӧ��H2��ת������ �� ��ʱ���÷�Ӧ�Ƿ�ﵽ��ƽ��״̬������ǡ�����
��ҵ���Ը���ˮ������Ϊ��Ӧ��ϵ��ϡ�ͼ��������뷴Ӧ����C8H10��g����ƽ��ת������ˮ��������������ϵ���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ͼ����ʾ��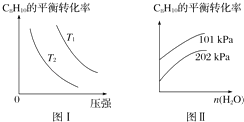
��4����ͼ���֪��T1T2������ڡ�����С�ڡ����ڡ�����
��5����ͼ���֪����������������ʱ��ˮ����������Խ��C8H10��ƽ��ת���ʽ����Խ����ԽС�����䡱����ԭ���� ��