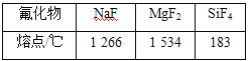
题目内容
【题目】今有某两种金属混合物4.5g,将其与足量的稀硫酸反应,能产生2.24L氢气(标准状况),则这两种金属可能是
A.镁和铝B.铝和钠C.钠和铜D.铜和锌
【答案】B
【解析】
假设金属都为+2价,根据电子转移守恒计算金属物质的量,再根据M=m÷n计算平均相对原子质量,平均相对原子质量应介于各组分之间,若金属不与稀硫酸反应,由电子转移守恒,可以视作其相对原子质量为无穷大,若反应中金属不表现+2价,按化合价与相对分子质量成正比关系折算+2价时相对分子质量。
标况下,2.24L氢气的物质的量为![]() =0.1mol,假设金属都为+2价,根据电子转移守恒,金属物质的量为0.1mol,金属平均相对原子质量为
=0.1mol,假设金属都为+2价,根据电子转移守恒,金属物质的量为0.1mol,金属平均相对原子质量为![]() =45。
=45。
A、Mg、Al均与硫酸反应生成氢气,Mg表现+2价,Mg相对原子质量为24,而Al表现+3价,若化合价为+2价,其相对分子质量折算为![]() =18,相对分子质量均小于45,故A不符合;
=18,相对分子质量均小于45,故A不符合;
B、铝和钠均与硫酸反应生成氢气,Na表现+1价,Na相对原子质量为23,其相对分子质量折算为23×2÷1=46,而Al表现+3价,若化合价为+2价,其相对分子质量折算为27×2÷3=18,相对分子质量一个小于45,另一个大于45,故B符合;
C、钠和铜,钠与硫酸反应生成氢气,Na表现+1价,Na相对原子质量为23,其相对分子质量折算为23×2÷1=46,铜不与硫酸反应,Cu的相对原子质量视作无穷大,相对分子质量均大于45,故C不符合;
D、铜和锌,铜不与硫酸反应,Cu的相对原子质量视作无穷大,锌与硫酸反应生成氢气,Zn表现+2价,Zn相对原子质量为65,相对分子质量均大于45,故D不符合;
故选B。

【题目】活性炭可处理大气污染物NO。为模拟该过程,T℃时,在3L密闭容器中加入NO和活性炭粉,反应体系中各物质的量变化如下表所示。下列说法正确的是
活性炭/mol | NO/mol | X/mol | Y/mol | |
起始时 | 2.030 | 0.100 | 0 | 0 |
10min达平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
A. X一定是N2,Y一定是CO2
B. 10min后增大压强,NO的吸收率增大
C. 10min后加入活性炭,平衡向正反应方向移动
D. 0~10min的平均反应速率v(NO)=0.002 mol/(Lmin)