题目内容
16.下列离子方程式书写正确的是( )| A. | 铁和稀盐酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 食盐水中滴加硝酸银溶液:Ag++Cl-═AgCl↓ | |
| D. | 石灰石与盐酸反应:CO32-+2H+═CO2↑+H2O |
分析 A.反应生成氯化亚铁和氢气;
B.漏写生成水的离子反应;
C.反应生成氯化银沉淀和硝酸钠;
D.碳酸钙在离子反应中保留化学式.
解答 解:A.铁和稀盐酸反应的离子反应为Fe+2H+═Fe2++H2↑,故A错误;
B.硫酸和氢氧化钡溶液反应的离子反应为SO42-+Ba2++2H++2OH-═2H2O+BaSO4↓,故B错误;
C.食盐水中滴加硝酸银溶液的离子反应为Ag++Cl-═AgCl↓,故C正确;
D.石灰石与盐酸反应的离子反应为CaCO3+2H+═CO2↑+H2O+Ca2+,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列各元素中,非金属性最强的是( )
| A. | O | B. | F | C. | P | D. | Cl |
7.m A(g)+n B(g)?p c(g),在同一压强下变化如图,叙述正确的是( )
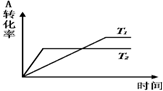

| A. | T1>T2,正反应是吸热反应 | B. | T1<T2,正反应是放热反应 | ||
| C. | T1<T2,正反应是吸热反应 | D. | T1>T2,正反应是放热反应 |
11.下列实验方案可行的是( )
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用BaCl2除去NaOH溶液中混有的少量Na2SO4 | |
| C. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 | |
| D. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 |
1.在下列溶液中,常温下各组离子一定能够大量共存的是( )
| A. | c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ | |
| D. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ |
6.下列与化学有关的说法中错误的是( )
| A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 合金超导材料是指熔合两种或两种以上的金属元素并形成具有超导电性的超导材料,如铌一钛(Nb-Ti)合金,它的熔点一般比纯钛要低 |
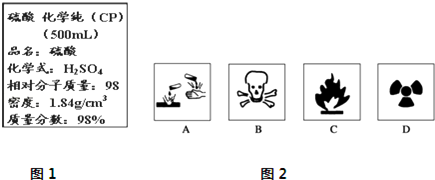
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: