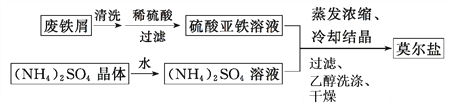
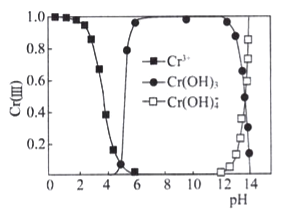
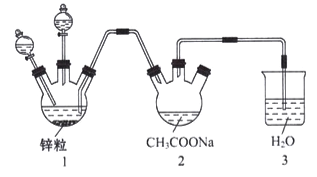
题目内容
【题目】一定条件下在2L的密闭容器中,充入2mol SO2和1molO2发生反应:2SO2(g) + O2(g) ![]() 2SO3(g)△H=﹣196kJmoL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
2SO3(g)△H=﹣196kJmoL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
A.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,V(正)>V(逆)
B.相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为20%
C.平衡混合气体中S02的物质的量为1.2mol
D.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收39.2kJ的热量
【答案】C
【解析】
试题分析:一定条件下在2L的密闭容器中,充入2mol SO2和1molO2,当气体的总物质的量减少0.8mol时反应达到平衡,则:
2SO2(g)+O2(g)![]() 2SO3(g) 物质的量减少△n=1
2SO3(g) 物质的量减少△n=1
起始量(mol):2 1 0
变化量(mol):1.6 0.8 1.6 0.8
平衡量(mol):0.4 0.2 1.6
A.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,平衡正向移动,则v (正)>v (逆),故A正确;B.相同温度下,起始时向容器中充入2mol SO3与原平衡等效,平衡时相同组分的物质的量相等,则转化的三氧化硫为2mol-1.6mol=0.4mol,故三氧化硫转化率为0.4mol/2mol×100%=20%,故B正确;C.依据上述分析可知,平衡时SO2的物质的量浓度为0.4nol/2L=0.2mol/L,故C错误;D.保持其他条件不变,若起始时向容器中充入2molSO3,与原平衡等效,平衡时三氧化硫的物质的量相等,转化的三氧化硫为2mol-1.6mol=0.4mol,故吸收的热量为196kJmoL-1×0.4mol/2mol=39.2kJ,故D正确。故选C。

 阅读快车系列答案
阅读快车系列答案【题目】如表是元素周期表的前四周期:
I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三 | G | H | I | |||||
四 | J |
回答下列问题:
(1)G元素与E元素形成含有非极性键的化合物的化学式是____,I与J的原子序数相差为_____.
(2)上述10种元素的最高价氧化物对应的水化物中,碱性最强的是__(用化合物的化学式表示,下同),酸性最强的是_____,E、F、G三种元素形成的简单离子半径由大到小的顺序是_______(用离子符号回答).