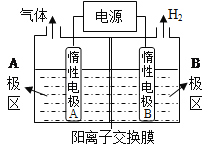
��Ŀ����
����Ŀ���ֶ�����Ԫ��A��B��C��D��ԭ��������������C��Dλ��ͬ������ԭ���������8����̬Aԭ�Ӻ�����3���ܼ������ɵ�����ÿ���ܼ��ϵ�������ȣ�Cԭ��s�ܼ�����������p�ܼ���������ȣ���̬Eԭ�ӵ�M������2��δ�ɶԵ������չ����
��1����̬Eԭ�ӵļ۲���ӹ����ʾʽΪ ��
��2��Ԫ��A��B��C�ĵ�һ�������ɴ�С����Ϊ (��Ԫ�ط��ű�ʾ)
��3��AC32-������ԭ���ӻ�����Ϊ ��DC32-�Ŀռ乹��Ϊ ��
��4����֪(DAB)2�����к��Ǽ��Լ���������ÿ��ԭ������㶼�ﵽ8�������ȶ��ṹ��1mol(DAB)2���Ӻ���������ĿΪ �� д��һ����DAB-���ӻ�Ϊ�ȵ�����ķ��� (�ѧʽ)
��5�������E(AC)4�ڳ����³�Һ̬�����������Ȼ�̼�������л��ܼ�����̬E(AC)4�ľ��������� ��
��6���˹��ϳɵ�EC�������ȱ�ݣ�����������+3��+2�����֡�ij���˺ϳɵľ�����Ʒ���ΪE0.96C����þ�����+3�ۡ�+2���������ӵĸ���֮��Ϊ
���𰸡���1��![]() ��
��
��2��N>O>C��
��3��sp2�ӻ��������Σ�
��4��5��6.02��1023��5 NA�� CO2(��N2O)��
��5�����Ӿ��壻
��6��1:11��
�����������������������Ԫ��A��B��C��D��ԭ��������������Cԭ��s�ܼ�����������p�ܼ���������ȣ�C�ĵ����Ų�Ϊ1s22s22p4��C��Dλ��ͬ������ԭ���������8����֪CΪO��DΪS����̬Aԭ�Ӻ�����3���ܼ������ɵ�����ÿ���ܼ��ϵ�������ȣ�A�ĵ����Ų�Ϊ1s22s22p2����AΪCԪ�أ����ԭ��������ϵ��֪BΪN����̬Eԭ�ӵ�M������2��δ�ɶԵ������չ����E�ĵ����Ų�Ϊ1s22s22p63s23p63d84s2����EΪNi��
��1����̬Eԭ�ӵļ۲�����Ų�ʽΪ 3d84s2�������ʾʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��2���ǽ�����ǿ�ĵ�һ�����ܴ�N��2p���Ӱ���Ϊ�ȶ��ṹ����a��b��c�У���һ�������ɴ�С����ΪN��O��C���ʴ�Ϊ��N��O��C��
��3��CO32-������ԭ��C�ŶԵ���Ϊ![]() (4+22��3)=0���ɼ���Ϊ3���ӻ�����Ϊsp2�ӻ���SO32-��S�ŶԵ���Ϊ
(4+22��3)=0���ɼ���Ϊ3���ӻ�����Ϊsp2�ӻ���SO32-��S�ŶԵ���Ϊ![]() (6+22��3)=1���ɼ���Ϊ3���ӻ�����Ϊsp3�ӻ����ռ乹��Ϊ�����ͣ��ʴ�Ϊ��sp2�� �����ͣ�
(6+22��3)=1���ɼ���Ϊ3���ӻ�����Ϊsp3�ӻ����ռ乹��Ϊ�����ͣ��ʴ�Ϊ��sp2�� �����ͣ�
��4��(SCN)2���ӽṹ�к�S-C��C��N�����ṹʽΪN��C-S-S-C��N������Ϊ�����������к�1��������1mol(dab)2���Ӻ���������ĿΪ1mol��5��6.02��1023=5��6.02��1023������dab��Ϊ�ȵ�����ķ�����ԭ����Ϊ3���۵�����Ϊ15����CO2(��N2O)���ʴ�Ϊ��5��6.02��1023��CO2(��N2O)��
��5�����������E(AC)4�ڳ����³�Һ̬�����������Ȼ�̼�������л��ܼ�����̬E(AC)4���ڷ��Ӿ��壬�ʴ�Ϊ�����Ӿ��壻
��6����1mol Ni0.96O�к�Ni3+xmol��Ni2+Ϊ(0.96-x)mol�����ݾ����Գʵ����ԣ���֪ 3x+2��(0.96-x)=2��1�����x=0.08mol��Ni2+Ϊ(0.96-x)mol=0.88mol����������֮��ΪNi3+��Ni2+=0.08��0.88=1��11���ʴ�Ϊ��1��11��

����Ŀ���Ͻ���ָ���ֻ��������ϵĽ������������ǽ������ۺ϶��ɵľ��н������Ե����ʡ������±����ݣ������γɺϽ����
Na | Cu | A1 | Fe | |
�۵�/�� | 97.8 | 1 083 | 660 | 1 535 |
�е�/�� | 883 | 2 567 | 2 467 | 2 750 |
A. Cu��A1 B. Fe��Na C. Fe��Cu D. A1��Na