题目内容
【题目】铬是人体必需的微量元素,铬元素形成的化合物很多,常见的有Cr2O3、(NH4)2Cr2O7、[Cr(CH3COO)2]22H2O等,请回答下列问题:
(1)铬熔点较高,一般应用铝热反应制备铬单质。写出利用Cr2O3制备单质铬的化学方程式 ____________________ 。
(2)实验室常用Fe2+处理含(NH4)2Cr2O7的废水,其流程如下:
Cr2O72﹣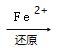 Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
①(NH4)2Cr2O7中铬的化合价为 ________ 。
②第一步的离子方程式为_____ 。
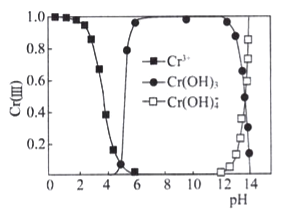
③已知三价铬[Cr(III)]在水溶液中的存在形态随pH的变化如下图,为尽可能除去铬元素实现废水达标排放,pH要控制在_______;若pH过高,溶液中残留铬量增大,其原因是 __________
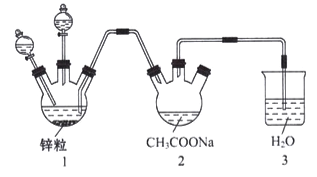
(3)醋酸亚铬水合物{[Cr(CH3COO)2]22H2O,相对分子质量为376} 是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为制备醋酸亚铬水合物,其装置如图所示,且仪器1中预先加入锌粒。
已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
a.Zn+2HCl═ZnCl2+H2↑
b.Zn+2CrCl3═2CrCl2+ZnCl2
c.2Cr2++4CH3COO+2H2O═[Cr(CH3COO)2]22H2O↓
①以上发生的反应中,属于氧化还原反应的是_______(填序号)。
②往仪器1中加入盐酸和三氯化铬溶液的顺序是先加入盐酸一段时间后再加入三氯化铬溶液,然后再加入盐酸。这样做的主要目的是____________________。
③已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1molL-1实验后得干燥纯净的[Cr(CH3COO)2]22H2O 9.48 g,则该实验所得产品的产率为 __________(保留两位有效数字)。
【答案】2Al+Cr2O3![]() 2Cr+Al2O3+6(价)Cr2O72-+14H++6Fe2+=2Cr3++7H2O+6Fe3+6~12Cr(OH)3转化为可溶性的Cr(OH)4-ab让锌粒与盐酸先反应产生H2,把装置中的空气赶出,避免生成的亚铬离子被氧化,然后再加入盐酸,利用产生的氢气把液体压入右边的仪器84%
2Cr+Al2O3+6(价)Cr2O72-+14H++6Fe2+=2Cr3++7H2O+6Fe3+6~12Cr(OH)3转化为可溶性的Cr(OH)4-ab让锌粒与盐酸先反应产生H2,把装置中的空气赶出,避免生成的亚铬离子被氧化,然后再加入盐酸,利用产生的氢气把液体压入右边的仪器84%
【解析】本题考查铬元素及其化合物性质、制备的知识点,可从题给的已知信息和图像及相关基础知识入手,根据氧化还原反应、离子反应、溶液的PH和实验操作的有关知识进行解答。
(1)Al的还原性大于Cr,可发生2Al+Cr2O3![]() 2Cr+Al2O3
2Cr+Al2O3
(2)①根据化合物中,化合价代数和为0,可知 (NH4)2Cr2O7中铬的化合价为+6
②Cr2O72﹣有氧化性,Fe2+有还原性,发生氧化还原反应,第一步的离子方程式为 Cr2O72-+14H++6Fe2+=2Cr3++7H2O+6Fe3+ 。
③除去铬元素实现废水达标排放,须使铬元素全部生成Cr(OH)3沉淀,由图像可知pH要控制在6~12之间。若pH过高,Cr(OH)3溶解于碱中,生成溶于水的Cr(OH)4- ,溶液中残留铬量增大。
(3)①a、b反应中有元素化合价的改变,是氧化还原反应,c 中元素化合价未变,不是氧化还原反应,因此属于氧化还原反应的是a、c
②二价铬不稳定,易被氧气氧化,为了防止被氧化,首先需要排尽装置中的空气,三氯化铬溶液在2装置中反应,必须将1装置中的三氯化铬溶液压入2中,所答案为:让锌粒与盐酸先反应产生H2,把装置中的空气赶出,避免生成的亚铬离子被氧化,然后再加入盐酸,利用产生的氢气把液体压入右边的仪器
③ CrCl3的物质的量为9.51/158.5=0.06(mol),醋酸钠的物质的量为1.5*0.1=0.15(mol),根据 2CrCl2+4CH3COONa+2H2O═[Cr(CH3COO)2]22H2O↓+4NaCl可知CrCl3全反应,则[Cr(CH3COO)2]22H2O的物质的量为0.03mpl,质量为0.03*376g=11.28g,产率为9.48/11.28=0.84,所以产率为84%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案