题目内容
【题目】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。
(1)制备莫尔盐的流程如下:
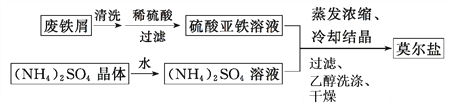
①用热的Na2CO3溶液清洗废铁屑的目的是__________。
②其中最后一步用少量无水乙醇洗涤晶体目的是________。
(2)现取0.4gCu2S和CuS的混合物在酸性溶液中用40mL0.150mol·L-1KMnO4溶液处理,发生反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O,
反应后煮沸溶液,赶尽SO2,剩余的KMnO4用0.2mol·L-1(NH4)2Fe(SO4)2溶液来滴定,完全反应消耗(NH4)2Fe(SO4)2溶液VmL。已知:MnO4-+Fe2++H+→Mn2++Fe3++H2O(未配平)
①滴定终点的现象为________。
②若V=35,试计算混合物中CuS的质量分数________(写出计算过程)。
【答案】除去废铁屑表面的油污洗去晶体表面杂质,减少晶体损失滴入最后一滴溶液时红色褪去,半分钟内不变红60%
V=35,与35mL(NH4)2Fe(SO4)2溶液完全反应需要高锰酸钾的物质的量为:
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1mol 5mol
0.014mol 0.035L×0.2mol·L-1
所以高锰酸钾的物质的量为0.0014mol,
故与固体混合物反应的高锰酸钾的物质的量为:0.150mol·L-1×0.040L-0.0014mol = 0.0046mol
设Cu2S物质的量为x,CuS物质的量为y
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
8mol 5mol
8x/5mol xmol
6MnO4-+5Cu2S+28H+=5Cu2++5SO2+6Mn2++14H2O
6mol 5mol
6y/5mol ymol
160x+96y=0.40g
8x/5mol+6y/5mol=0.0046mol
解得x=0.001mol,y=0.0025mol
则混合物中CuS的质量分数为0.0025mol×96g/0.4g×100%=60%
【解析】
(1)①铁屑表面常有油污,这些油污阻碍铁屑和硫酸的接触,需要除去,碳酸钠的水溶液显碱性,油污在碱性中完全水解,因此碳酸钠的作用是除去铁屑表面的油污;②莫尔盐不溶于乙醇,用乙醇洗涤可以减少莫尔盐的溶解,同时乙醇易挥发;(2)①用(NH4)2Fe(SO4)2滴定高锰酸钾溶液,Fe2+能使酸性高锰酸钾溶液褪色,因此滴定到终点的现象是滴入最后一滴时紫红色褪去,且半分钟不变色;②V=35,与35mL(NH4)2Fe(SO4)2溶液完全反应需要高锰酸钾的物质的量为:
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1mol 5mol
0.014mol 0.035L×0.2mol·L-1
所以高锰酸钾的物质的量为0.0014mol,
故与固体混合物反应的高锰酸钾的物质的量为:0.150mol·L-1×0.040L-0.0014mol = 0.0046mol
设Cu2S物质的量为x,CuS物质的量为y 根据得失电子数目守恒,2x×1+6x+6y=0.0046×5,根据题意得出160x+96y=0.40g
解得x=0.001mol,y=0.0025mol
则混合物中CuS的质量分数为0.0025mol×96g/0.4g×100%=60%

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
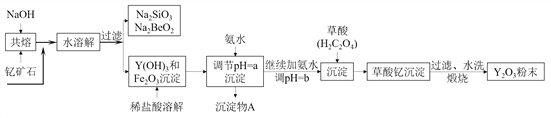
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.7 | 3.7 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。请回答下列问题:
(1)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
①最好选用盐酸和__________两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式__________。
(2)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在__________范围内;继续加氨水调节pH=b发生反应的离子方程式为__________;检验Fe3+是否沉淀完全的操作方法是__________。
(3)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式__________。
