题目内容
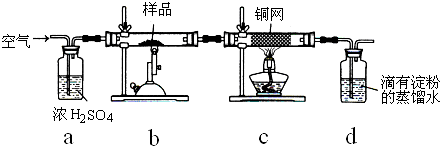
 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
(1)若A为水,B为过氧化钠,C中盛有盐酸酸化过的FeCl2溶液,旋开活塞E后,B中发生反应的化学方程式为______;C中现象为______.
(2)若A为硫酸,B为亚硫酸钠固体,C中盛有氢硫酸溶液,旋开活塞E后,B中发生反应的化学方程式的为______,C中发生反应的化学方程式的为______.
(3)利用上述装置还可以验证物质的性质,如设计证明氧化性:KClO3>Cl2>Br2,则A中加浓盐酸,B中加______,C中发生反应的离子方程式为______.
解:(1)过氧化钠与水反应生成氧气,反应的化学方程式为2Na2O2+2H2O═4NaOH+O2,氯气具有强氧化性,能将Fe2+离子氧化物Fe3+离子,溶液变黄,
故答案为:2Na2O2+2H2O═4NaOH+O2;变黄或加深;
(2)硫酸与亚硫酸钠反应生成二氧化硫气体,反应方程式为H2SO4+Na2SO3═Na2SO4+H2O+SO2,二氧化硫具有氧化性,硫化氢具有还原性,二者发生氧化还原反应生成单质硫,反应的化学方程式为2H2S+SO2═3S+2H2O,故答案为:H2SO4+Na2SO3═Na2SO4+H2O+SO2;2H2S+SO2═3S+2H2O;
(3)根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,证明氧化性:KClO3>Cl2>Br2,可将KClO3作为氧化剂和盐酸反应判断是否生成氯气,如氯气氧化性大于Br2,则将氯气通入NaBr溶液中溶液变为橙红色,说明有Br2生成,反应的化学方程式为2Br-+Cl2═2Cl-+Br2,
故答案为:KClO3;2Br-+Cl2═2Cl-+Br2.
分析:(1)过氧化钠与水反应生成氧气,亚铁离子具有还原性,溶液盐酸呈浅绿色,被氧气氧化成铁离子,溶液变黄;
(2)硫酸与亚硫酸钠反应生成二氧化硫气体,二氧化硫具有氧化性,硫化氢具有还原性,二者发生氧化还原反应生成单质硫;
(3)根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,判断可能发生的反应.
点评:本题考查元素化合物知识,题目难度不大,注意过氧化钠、亚硫酸钠的性质,以及实验设计的方案的设计.
故答案为:2Na2O2+2H2O═4NaOH+O2;变黄或加深;
(2)硫酸与亚硫酸钠反应生成二氧化硫气体,反应方程式为H2SO4+Na2SO3═Na2SO4+H2O+SO2,二氧化硫具有氧化性,硫化氢具有还原性,二者发生氧化还原反应生成单质硫,反应的化学方程式为2H2S+SO2═3S+2H2O,故答案为:H2SO4+Na2SO3═Na2SO4+H2O+SO2;2H2S+SO2═3S+2H2O;
(3)根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,证明氧化性:KClO3>Cl2>Br2,可将KClO3作为氧化剂和盐酸反应判断是否生成氯气,如氯气氧化性大于Br2,则将氯气通入NaBr溶液中溶液变为橙红色,说明有Br2生成,反应的化学方程式为2Br-+Cl2═2Cl-+Br2,
故答案为:KClO3;2Br-+Cl2═2Cl-+Br2.
分析:(1)过氧化钠与水反应生成氧气,亚铁离子具有还原性,溶液盐酸呈浅绿色,被氧气氧化成铁离子,溶液变黄;
(2)硫酸与亚硫酸钠反应生成二氧化硫气体,二氧化硫具有氧化性,硫化氢具有还原性,二者发生氧化还原反应生成单质硫;
(3)根据氧化剂+还原剂=氧化产物+还原产物,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,判断可能发生的反应.
点评:本题考查元素化合物知识,题目难度不大,注意过氧化钠、亚硫酸钠的性质,以及实验设计的方案的设计.

练习册系列答案
相关题目
 国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题:
国务院强调,“南水北调”工程必须坚持节水、治污和生态环境保护与工程建设相协调,以水资源合理配置为主线,把节水、治污、生态环境保护与调水作为一个完整的系统来分析的原则.在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的Mg2+、Al3+、Cu2+、Ag+.试分析回答下列问题: 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题: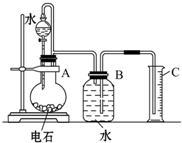 某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.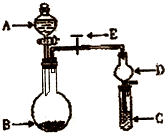 (2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答:
(2010?临沂一模)化学实验中一套装置往往可以完成多个实验,A某同学设计了如图所示装置(夹持仪器省略)进行系列实验.请回答: