题目内容
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: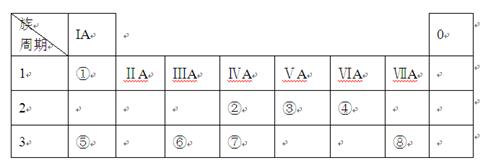
(1)⑤、⑥、⑦元素的原子半径由大到小的顺序为 。 (2)②、③、⑦元素的最高价含氧酸的酸性由强到弱的顺序是 。
(2)②、③、⑦元素的最高价含氧酸的酸性由强到弱的顺序是 。 (3)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) 。
(3)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号) 。 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 (4)元素⑥的氯化物溶液与稀氨水溶液反应的离子方程式 。
(4)元素⑥的氯化物溶液与稀氨水溶液反应的离子方程式 。
工业上冶炼单质⑥的反应原理 。
(5)某无色稀溶液X含有四种阴离子,是由②④⑥⑦⑧元素中的一种或两种组成。现取该溶液适量,向其中加入稀盐酸,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。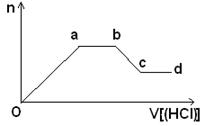
则oa段转化为沉淀的离子(指来源于X溶液,下同)是________,ab段发生反应的离子是________,bc段发生反应的离子方程式为_____________________________________。
(1)Na>Al>Si (2)HNO3>H2CO3>H2SiO3 (3)a b
(4)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
(5)SiO、AlO ;CO ;Al(OH)3+3H+=Al3++3H2O
解析试题分析:元素①-⑧分别为H、C、N、O、 Na、 Al、 Si、Cl。(1)同周期元素,从左往右,原子半径逐渐减小,故原子半径Na>Al>Si;(2)非金属的氧化性越强,其最高价含氧酸的酸性越大;(3)由表中两种元素的原子按1︰1组成的常见液态化合物为过氧化氢,故常见的催化剂为MnO2和FeCl3;(4)Al3+与强碱反应,生成AlO;与弱碱反应,生成Al(OH)3;Al为活泼金属,通过电解熔融的Al2O3冶炼;(5)由元素②④⑥⑦⑧组成的阴离子有SiO、AlO 、CO和Cl-;oa段是SiO变成H3SiO4,AlO变成Al(OH)3;ab段是CO与盐酸反应生成CO2;bc段是Al(OH)3溶解。
考点:元素周期表及其规律
点评:元素周期表及其规律是高考必考知识点,考生在备考中应注意积累掌握短周期元素的结构与性质。










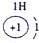
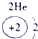
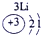
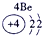
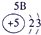
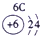
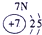
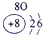
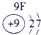
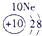
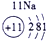





 表示的是
表示的是