题目内容
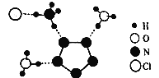
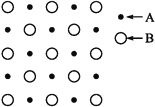
【题目】(1)某物质的晶体内部一个截面上原子的排布情况如图所示,则该晶体的化学式可表示为________
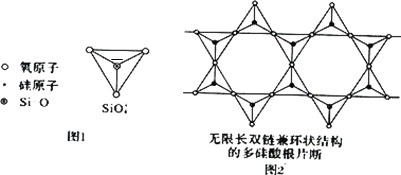
(2)Si 元素以 Si-O-Si 链构成矿物界,由许多四面体(图 l)连接成无限长的单链或双链(图 2)结构。图 2 所示的多硅酸根离子的化学式通式为________(以含正整数 n 的代数式表示)。
【答案】AB (Si4O11)n6n
【解析】
(1)根该晶体一截面上原子原子的排布情况可知,每一个A原子周围有2个B原子,每一个B原子周围有2个A原子,所以该晶体的化学式可以表示为AB。
(2)由许多四面体构成,每个Si与周围4个氧原子形成四面体,取图中所示结构单元: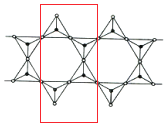 ,结构单元中处于共用边上的O原子为每个结构单元提供
,结构单元中处于共用边上的O原子为每个结构单元提供![]() ,处于结构单元内的氧原子有9个,其中4个的投影与Si重合,故结构单元共用氧原子数目为9+4×
,处于结构单元内的氧原子有9个,其中4个的投影与Si重合,故结构单元共用氧原子数目为9+4×![]() =11,结构单元内Si原子4个,结构单元化合价为:(-2)×11+(+4)×4=-6,故该多硅酸根离子的化学式通式为(Si4O11)n6n。
=11,结构单元内Si原子4个,结构单元化合价为:(-2)×11+(+4)×4=-6,故该多硅酸根离子的化学式通式为(Si4O11)n6n。

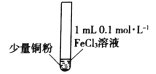
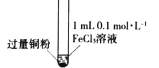
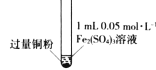
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___;
(2)该反应为___(填“吸热”或“放热”)反应;
(3)能判断该反应达到化学平衡状态的依据是___;
A.容器中压强不变
B.混合气体中c(CO)不变
C.V正(H2)=V逆(H2O)
D.c(CO2)=c(CO)
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,则下一时刻,反应向___(填“正向”或“逆向”)进行。