题目内容
【题目】利用水热和有机溶剂等软化学方法,可合成出含有有机杂化锌、锗以及砷等金属的硒化物,且该硒化物具有离子交换、催化、吸附、半导体等性能,显示出良好的应用前景。回答下列问题:
(1)锌基态原子核外电子排布式为________________。元素锗与砷中,第一电离能较大的是_________(填元素符号,下同),基态原子核外未成对电子数较少的是_______________。
(2)H2SeO3分子中Se原子的杂化形式为____________,H2SeO4的酸性比H2SeO3强,原因是_________。
(3)气态SeO3分子的立体构型为____________,与SeO3互为等电子体的一种离子为_______(填离子符号)。
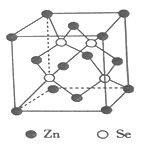
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为____________,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1。用NA代表阿伏伽德罗常数的数值,则晶胞参数ɑ为____________nm。
【答案】 1s22s22p63s23p63d104s2{[Ar]3d104s2} As Ge sp3 H2SeO4分子中非羟基的氧原子数大于H2SeO3 平面三角形 CO32-(或NO3-) 4 ![]() ×107
×107
【解析】(1)Zn原子核外电子数为30,核外电子排布式为1s22s22p63s23p63d104s2{[Ar]3d104s2};同周期元素从左到右第一电离能逐渐增大,As的4p能级含有3个电子,为半满稳定状态,第一电离能较高,故元素锗与砷中,第一电离能较大的是As;元素锗与砷中,基态原子核外未成对电子数分别为2和3,较少的是Ge;(2) H2SeO3分子中Se原子在S8分子中S原子成键电子对数为4,孤电子对数为1,即价层电子对数为4,所以其杂化轨道类型为sp3;H2SeO3的分子结构为![]() ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为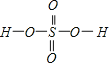 ,Se为+6价,H2SeO4分子中非羟基的氧原子数大于H2SeO3,后者Se原子吸电子能力强,则羟基上氢原子更容易电离出H+;(3)根据价层电子对互斥理论可知,SeO3分子中中心原子含有的孤对电子对数=
,Se为+6价,H2SeO4分子中非羟基的氧原子数大于H2SeO3,后者Se原子吸电子能力强,则羟基上氢原子更容易电离出H+;(3)根据价层电子对互斥理论可知,SeO3分子中中心原子含有的孤对电子对数=![]() =0,即气态SeO3分子中Se形成3个δ键,没有孤电子对,所以该分子形成的空间构型是平面三角形;SeO3是24e-,24e-等电子体有:NO3-、CO32-等;(4)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,所以硒原子的配位数为4,该晶胞中含有硒原子个数为8
=0,即气态SeO3分子中Se形成3个δ键,没有孤电子对,所以该分子形成的空间构型是平面三角形;SeO3是24e-,24e-等电子体有:NO3-、CO32-等;(4)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,所以硒原子的配位数为4,该晶胞中含有硒原子个数为8![]() +6×
+6×![]() =4,根据
=4,根据![]() =
=![]() =
=![]() ,所以V=
,所以V=![]() ,则晶胞的边长为:
,则晶胞的边长为:![]() cm=
cm=![]() ×107nm。
×107nm。

【题目】现有四组分散系:①汽油和水形成的乳浊液 ②含有泥沙的食盐水 ③溶有碘(I2)的碘化钾溶液 ④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表).
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )
A.①﹣(3)﹣分液
B.②﹣(2)﹣过滤
C.③﹣(2)﹣萃取
D.④﹣(1)﹣蒸馏