题目内容
【题目】下列叙述正确的是( )
A.将30 mL 0.5 mol/L NaOH溶液加水稀释到500 mL,所得溶液的NaOH的浓度为0.3 mol/L
B.配制250 mL 1.0 mol/L H2SO4溶液,需要18 mol/L的浓H2SO4的体积约为13.9 mL
C.0.270 kg质量分数为10%的CuCl2溶液中Cl﹣的物质的量为0.2 mol
D.80 g NaOH溶于1 L水中所得的溶液的物质的量浓度为2 mol/L
【答案】B
【解析】解:A.令稀释后NaOH的物质的量浓度为c,稀释前后氢氧化钠的物质的量不变,则:0.03L×0.5mol/L=c×0.5L,解得c=0.03mol/L,故A错误;B.设需要浓硫酸的体积为x,根据稀释定律,稀释前后溶质的物质的量不变,则:250mL×1.0mol/L=x×18mol/L,解得x=13.9mL,故B正确;
C.0.270kg质量分数为10%的CuCl2溶液中m(CuCl2)=270g×10%=27g,所以n(CuCl2)= ![]() =0.2mol,则Cl﹣的物质的量为0.4mol,故C错误;
=0.2mol,则Cl﹣的物质的量为0.4mol,故C错误;
D.80 g NaOH溶于1 L水中,溶液的体积不等于水的体积,所以溶液的体积不知道,则不能计算物质的量浓度,故D错误.
故选B.

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
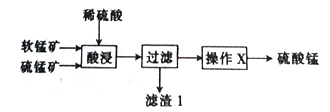
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。