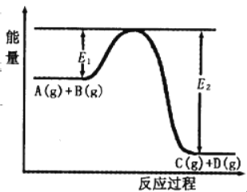
题目内容
【题目】下列互为同位素的是( )
A. H2D2 B. 14N14C C. 16O17O D. O2O3
【答案】C
【解析】试题分析:质子数相同中子数不同的原子互称同位素,互为同位素原子具有以下特征:质子数相同、中子数不同,研究对象为原子.
解:A.H2、D2是由不同氢原子组成的单质,故A错误;
B.14N、14C不是同一种元素组成的核素,故B错误;
C.16O、17O都是氧元素组成的不同核素,互为同位素,故C正确;
D.O2、O3是由氧元素组成的结构不同的单质,互为同素异形体,故D错误.
故选C.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族) ;
(2)8个元素的最高价氧化物的水化物中,酸性最强的是 (填化学式);
(3)元素⑤、⑦、⑧分别形成的简单气态氢化物中,⑦的电子式为 ,稳定性最强的氢化物的结构式为 ;
(4)写出①、④的最高价氧化物对应的水化物之间发生反应的离子方程式 ;
(5)用电子式表示元素①与⑥形成化合物的过程 。