ЬтФПФкШн
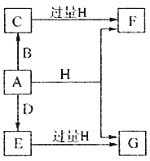
ЁОЬтФПЁПAЁЂBЁЂDКЭEЫФжждЊЫиОљЮЊЖЬжмЦкдЊЫи,дзгађЪ§ж№НЅдіДѓЁЃAдЊЫидзгЕФКЫЭтЕчзгЪ§ЁЂЕчзгВуЪ§КЭзюЭтВуЕчзгЪ§ОљЯрЕШЁЃBЁЂDЁЂEШ§жждЊЫидкжмЦкБэжаЯрЖдЮЛжУШчЭМЫљЪОЃК

жЛгаEдЊЫиЕФЕЅжЪФмгыЫЎЗДгІЩњГЩСНжжЫсЁЃМзЁЂввЁЂMЁЂWЁЂXЁЂYЁЂZЦпжжЮяжЪОљгЩAЁЂBЁЂDШ§жждЊЫижаЕФвЛжжЛђМИжжзщГЩ,ЦфжажЛгаMЗжзгЭЌЪБКЌгаШ§жждЊЫи;WЮЊN2H4,ПЩзїЛ№М§ШМСЯ;МзЁЂввЮЊЗЧН№ЪєЕЅжЪ;XЗжзгжаКЌга10ИіЕчзг,ЫќУЧжЎМфЕФзЊЛЏЙиЯЕШчЭМЫљЪОЃК

ЛиД№ЯТСаЮЪЬт:
(1)МзКЭввЩњГЩБъзМзДПіЯТ1.12 L Y,ЮќЪе9.025 kJЕФШШСП,аДГіЗДгІЕФШШЛЏбЇЗНГЬЪН:____ЁЃ
(2)вЛЖЈСПEЕФЕЅжЪгыNaOHШмвКЧЁКУЭъШЋЗДгІКѓ,ЫљЕУШмвКЕФpH__7(ЬюЁАДѓгкЁБЁАЕШгкЁБЛђЁАаЁгкЁБ),двђЪЧ________(гУРызгЗНГЬЪНБэЪО)ЁЃ
(3)W-ПеЦјШМСЯЕчГиЪЧвЛжжМюадШМСЯЕчГи,ЕчНтжЪШмвКЪЧ20%~30%ЕФKOHШмвКЁЃW-ПеЦјШМСЯЕчГиЗХЕчЪБ,е§МЋЗДгІЪНЮЊ_____________,ИКМЋЗДгІЪНЮЊ_________ЁЃ
(4)НЋвЛЖЈСПЕФA2ЁЂB2ЛьКЯЦјЬхЗХШы1 LУмБеШнЦїжа,дк500 ЁцЁЂ2ЁС107PaЯТЗДгІДяЕНЦНКт,ВтЕУЦНКтЦјЬхЕФзмЮяжЪЕФСПЮЊ0.5 mol,ЦфжаA2ЮЊ0.3 mol,B2ЮЊ0.1 molЁЃдђИУЬѕМўЯТA2ЕФЦНКтзЊЛЏТЪЮЊ____,ИУЮТЖШЯТИУЗДгІЕФЦНКтГЃЪ§ЮЊ_____ЁЃ
(5)дкУмБеШнЦїжаГфШывЛЖЈСПЕФA2ЁЂB2ЛьКЯЦјЬхЃЌИФБфЭтНчЬѕМўЃЌH2ЕФзЊЛЏТЪБфЛЏШчЭМЫљЪОЃКдђXПЩДњБэЪВУД____ЃП

AЁЂЮТЖШЕФБфЛЏ BЁЂбЙЧПЕФБфЛЏ CЁЂn(B2)/n(A2)ЕФБфЛЏ DЁЂДпЛЏМСНгДЅУцЛ§ЖрЩй
ЁОД№АИЁПN2(g)+O2(g)=2NO(g)ЁЁІЄH= -361 kJЁЄmol-1 Дѓгк ClO-+H2O![]() HClO+OH- O2+2H2O+4e-=4OH- N2H4+4OH--4e-=N2+4H2O 33.3% 100/27 (molЁЄL-1) BC
HClO+OH- O2+2H2O+4e-=4OH- N2H4+4OH--4e-=N2+4H2O 33.3% 100/27 (molЁЄL-1) BC
ЁОНтЮіЁП
БОЬтЮЊЮоЛњЮяЕФЭЦЖЯЁЃAЁЂBЁЂDЁЂEЫФжждЊЫиОљЮЊЖЬжмЦкдЊЫиЃЌдзгађЪ§ж№НЅдіДѓЁЃAдЊЫидзгЕФКЫЭтЕчзгЪ§ЁЂЕчзгВуЪ§КЭзюЭтВуЕчзгЪ§ОљЯрЕШЃЌЭЦжЊдЊЫиAЪЧHЃЛгЩдЊЫидкжмЦкБэжаЮЛжУЃЌПЩжЊBЁЂDЮЛгкЕкЖўжмЦкЃЌEЮЛгкЕкШ§жмЦкЃЌЖјEдЊЫиЕФЕЅжЪФмгыЫЎЗДгІЩњГЩСНжжЫсЃЌдђEЮЊClЃЌПЩЭЦжЊBЮЊNдЊЫиЁЂDЮЊOдЊЫиЃЛМзЁЂввЁЂMЁЂWЁЂXЁЂYЁЂZЦпжжЮяжЪОљгЩHЁЂNЁЂOШ§жждЊЫижаЕФвЛжжЛђМИжжзщГЩЃЌЦфжаWЮЊN2H4ЃЌМзЁЂввЮЊЗЧН№ЪєЕЅжЪЃЌXЗжзгКЌга10ИіЕчзгЃЌНсКЯзЊЛЏЙиЯЕПЩжЊЃЌМзЪЧO2ЁЂввЪЧN2ЁЂXЪЧH2OЃЌвРДЮПЩЭЦЕМГіYЪЧNOЁЂZЪЧNO2ЁЂMЪЧHNO3ЃЌОнДЫНтД№ЁЃ
AЁЂBЁЂDЁЂEЫФжждЊЫиОљЮЊЖЬжмЦкдЊЫиЃЌдзгађЪ§ж№НЅдіДѓЃЌAдЊЫидзгЕФКЫЭтЕчзгЪ§ЁЂЕчзгВуЪ§КЭзюЭтВуЕчзгЪ§ОљЯрЕШЃЌЭЦжЊдЊЫиAЪЧHЃЛгЩдЊЫидкжмЦкБэжаЮЛжУЃЌПЩжЊBЁЂDЮЛгкЕкЖўжмЦкЃЌEЮЛгкЕкШ§жмЦкЃЌЖјEдЊЫиЕФЕЅжЪФмгыЫЎЗДгІЩњГЩСНжжЫсЃЌдђEЮЊClЃЌПЩЭЦжЊBЮЊNдЊЫиЁЂDЮЊOдЊЫиЃЛМзЁЂввЁЂMЁЂWЁЂXЁЂYЁЂZЦпжжЮяжЪОљгЩHЁЂNЁЂOШ§жждЊЫижаЕФвЛжжЛђМИжжзщГЩЃЌЦфжаWЮЊN2H4ЃЌМзЁЂввЮЊЗЧН№ЪєЕЅжЪЃЌXЗжзгКЌга10ИіЕчзгЃЌНсКЯзЊЛЏЙиЯЕПЩжЊЃЌМзЪЧO2ЁЂввЪЧN2ЁЂXЪЧH2OЃЌвРДЮПЩЭЦЕМГіYЪЧNOЁЂZЪЧNO2ЁЂMЪЧHNO3ЁЃ
ЃЈ1ЃЉбѕЦјКЭЕЊЦјЩњГЩБъзМзДПіЯТ1.12LNOЮќЪе9.025kJЕФШШСПЃЌМДЩњГЩ0.05molNOЮќЪе9.025 kJЕФШШСПЃЌдђЩњГЩ2molNOЮќЪеЕФШШСПЮЊ9.025kJЁС4=361kJЃЌЫљвдИУЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊN2(g)+O2(g)=2NO(g)ЁїH=+361kJ/molЁЃБОаЁЬтД№АИЮЊЃКN2(g)+O2(g)=2NO(g)ЁїH=+361kJ/molЁЃ
ЃЈ2ЃЉвЛЖЈСПТШЦјгыNaOHШмвКЧЁКУЭъШЋЗДгІКѓЕУЕНЕШХЈЖШЕФNaClЁЂNaClOШмвКЃЌШмвКжаДЮТШЫсИљРызгЫЎНтЃЌЫЎНтЕФРызгЗНГЬЪНЮЊClO+H2OHClO+OHЃЌЦЦЛЕЫЎЕФЕчРыЦНКтЃЌШмвКГЪМюадЃЌЫљЕУШмвКЕФpHДѓгк7ЁЃБОаЁЬтД№АИЮЊЃКДѓгкЃЛClO+H2OHClO+OHЁЃ
ЃЈ3ЃЉе§МЋЗЂЩњЛЙдЗДгІЃЌбѕЦјдке§МЋЕУЕчзгЃЌМюадЬѕМўЯТЩњГЩOHе§МЋЗДгІЪНЮЊЃКO2+2H2O+4e=4OHЃЌИКМЋЗЂЩњбѕЛЏЗДгІЃЌЪЇШЅЕчзгЃЌМюадЬѕМўЯТЩњГЩЕЊЦјгыЫЎЃЌИКМЋЗДгІЪНЮЊЃКN2H4+4OH4eЈTN2+4H2OЁЃБОаЁЬтД№АИЮЊЃКO2+2H2O+4e=4OHЃЛN2H4+4OH4eЈTN2+4H2OЁЃ
ЃЈ4ЃЉВтЕУЦНКтЦјЬхЕФзмЮяжЪЕФСПЮЊ0.50molЃЌЦфжаA2ЮЊ0.3molЃЌB2ЮЊ0.1molЃЌдђЃК
3H2(g)+N2(g)2NH3(g)
ПЊЪМ(mol) 0.45 0.15 0
зЊЛЏ(mol) 0.15 0.05 0.1
ЦНКт(mol) 0.3 0.1 0.50.30.1=0.1
дђИУЬѕМўЯТH2ЕФЦНКтзЊЛЏТЪЮЊ0.15mol/0.45molЁС100%=33.3%ЃЌ
ШнЦїЬхЛ§ЮЊ1LЃЌгУЮяжЪЕФСПДњЬцХЈЖШМЦЫуЦНКтГЃЪ§ЃЌдђK=0.12/(0.33ЁС0.1)=100/27
БОаЁЬтД№АИЮЊЃК33.3%ЃЛ100/27ЁЃ
ЃЈ5ЃЉвбжЊЗДгІ3H2(g)+N2(g)2NH3(g)ЁїH<0ЃЌЭМжаБэЪОH2ЕФзЊЛЏТЪЫцБфСПXЕФдіДѓЖјдіДѓЃЌдђЃК
A.Щ§ИпЮТЖШЦНКтФцЯђвЦЖЏЃЌH2ЕФзЊЛЏТЪНЕЕЭЃЌЙЪAДэЮѓЃЛ
B.діДѓбЙЧПЦНКте§ЯђвЦЖЏЃЌH2ЕФзЊЛЏТЪЩ§ИпЃЌЙЪBе§ШЗЃЛ
C.n(B2)/n(A2)діДѓЃЌЫЕУїЪЧдіДѓN2ЕФСПЛђМѕаЁH2ЕФСПЃЌH2ЕФзЊЛЏТЪОљдіДѓЃЌЙЪCе§ШЗЃЛ
D.ДпЛЏМСВЛИФБфЦНКтЕФвЦЖЏЃЌВЛгАЯьH2ЕФзЊЛЏТЪЃЌЙЪDДэЮѓЁЃБОаЁЬтД№АИЮЊЃКBCЁЃ