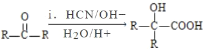题目内容
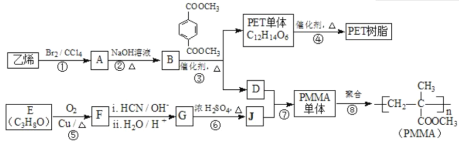
【题目】利用苯甲醛(C6H5CHO)在NaOH溶液中可以制苯甲醇(C6H5CH2OH)和苯甲酸(C6H5COOH)。实验流程如图:

相关物质的性质如下表所示。回答下列问题:
物质 | 对水的相对密度 | 沸点 | 溶解性 |
苯甲醇 | 1.04 | 205.7 | 微溶于水,易溶于乙醚 |
苯甲酸 | 1.27 | 249 | 微溶于冷水,可溶于热水,易溶于乙醚 |
乙醚 | 0.71 | 34.6 | 与水互不相溶 |
(1)操作①中,需要用到的玻璃仪器除烧杯外,还有____。操作①后,苯甲醇在容器中混合物的_____(填“上”或“下”)层。
(2)乙醚层用10%Na2CO3溶液洗涤的目的是_____。操作②前常需要加入MgSO4,作用是______。操作②的装置如图,指出该装置图中两个错误:______。
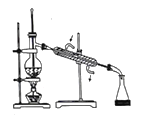
(3)操作③是______,操作④是______。
(4)取106.00g苯甲醛反应,若苯甲醛的转化率为80%,乙醚的萃取率为100%,洗涤等过程损失率为10%,则最终可制得苯甲醇___g(结果保留小数点后两位)。
【答案】分液漏斗 上 除去乙醚中溶解的少量苯甲酸 除水 温度计的水银球在液面以下,冷却水上进下出 过滤 蒸发浓缩、冷却结晶 38.88
【解析】
(1)根据流程,操作①得到乙醚层和水层,即该操作步骤为分液,分液时需要的仪器是带铁圈的铁架台、烧杯、分液漏斗,因此缺少的玻璃仪器是分液漏斗;根据表格的数据,乙醚的密度小于水的密度,以及苯甲醇易溶于乙醚,即苯甲醇在容器中混合物的上层;
答案为分液漏斗;上层;
(2)苯甲醛与NaOH溶液反应的方程式为2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa,苯甲酸钠发生水解,生成少量的苯甲酸,根据表格,苯甲酸易溶于乙醚,即乙醚层中溶有少量的苯甲酸,因此用Na2CO3洗涤的目的是除去乙醚中溶解的少量苯甲酸;MgSO4具有吸水性,因此加入MgSO4的目的是除去乙醚层中的水;该装置为蒸馏装置,错误出:一是温度计水银球在液面以下,应在支管口略低处;二是冷却水的进水和出水方向错误,应是下进上出;
答案是除去乙醚中溶解的少量苯甲酸;除水;温度计的水银球在液面以下,冷却水上进下出;
(3)水层中含有苯甲酸钠,加入盐酸发生C6H5COONa+HCl→C6H5COOH+NaCl,因为苯甲酸微溶于冷水,冷却后,苯甲酸固体析出,即操作③为过滤;操作④是从溶液中得到苯甲酸,因此操作④是蒸发浓缩、冷却结晶;
答案是过滤;蒸发浓缩、冷却结晶;
(4)苯甲醛与NaOH溶液反应的方程式为2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa,C6H5CONa+HCl→C6H5COOH+NaCl,最终制得苯甲醇的质量为![]() =38.88g;
=38.88g;
答案是38.88g。

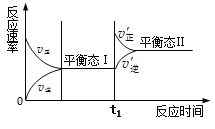
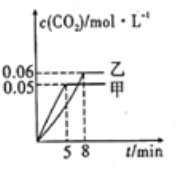
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g);
2SO3(g); ![]() 。实验测得起始、平衡时的有关数据如下表:
。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是 ( )
A.Q1=Q2=Q3="197" kJ
B.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最大