题目内容
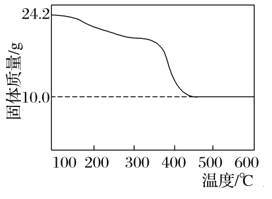
【题目】现有48.4 g碱式碳酸镁样品(化学式:xMgCO3·yMg(OH)2·zH2O,x、y、z为正整数),将其分为二等份,一份样品充分灼烧至恒重进行热重分析,结果如图所示。另一份投入150 mL某浓度的盐酸中,充分反应后生成CO2 4.48 L(已折算成标准状况下),所得溶液稀释至250 mL,测得溶液的c(H+)=0.100 mol·L-1。
按要求回答下列问题:
(1)盐酸的物质的量浓度c(HCl)=________mol·L-1。
(2)x∶y∶z=________。
【答案】 3.50 )4∶1∶5
【解析】(1)24.2g样品与盐酸反应放出的二氧化碳的物质的量为![]() =0.2mol,即n(MgCO3)=0.2mol,将24.2g样品灼烧至恒重得到10.0g氧化镁,含有镁元素的物质的量为
=0.2mol,即n(MgCO3)=0.2mol,将24.2g样品灼烧至恒重得到10.0g氧化镁,含有镁元素的物质的量为![]() =0.25mol,则n[Mg(OH)2]=0.25mol-0.2mol=0.05mol,反应的盐酸的物质的量为0.2mol×2+0.05mol×2=0.5mol,溶液中剩余的氢离子的物质的量为0.100 mol·L-1×0.25L=0.025mol,因此盐酸中氯化氢的总量为0.5mol+0.025mol=0.525mol,则c(HCl)=
=0.25mol,则n[Mg(OH)2]=0.25mol-0.2mol=0.05mol,反应的盐酸的物质的量为0.2mol×2+0.05mol×2=0.5mol,溶液中剩余的氢离子的物质的量为0.100 mol·L-1×0.25L=0.025mol,因此盐酸中氯化氢的总量为0.5mol+0.025mol=0.525mol,则c(HCl)=![]() =3.50mol/L,故答案为:3.50;
=3.50mol/L,故答案为:3.50;
(2)根据题意,24.2g样品与盐酸反应放出的二氧化碳的物质的量为![]() =0.2mol,即n(MgCO3)=0.2mol,将24.2g样品灼烧至恒重得到10.0g氧化镁,含有镁元素的物质的量为
=0.2mol,即n(MgCO3)=0.2mol,将24.2g样品灼烧至恒重得到10.0g氧化镁,含有镁元素的物质的量为![]() =0.25mol,则n[Mg(OH)2]=0.25mol-0.2mol=0.05mol,含有结晶水的质量为24.2g-0.2mol×84g/mol-0.05mol×58g/mol=4.5g,物质的量为
=0.25mol,则n[Mg(OH)2]=0.25mol-0.2mol=0.05mol,含有结晶水的质量为24.2g-0.2mol×84g/mol-0.05mol×58g/mol=4.5g,物质的量为![]() =0.25mol,x∶y∶z=0.2mol:0.05mol:0.25mol=4∶1∶5。
=0.25mol,x∶y∶z=0.2mol:0.05mol:0.25mol=4∶1∶5。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如下图所示。Fe(OH)3、Al(OH)3沉淀的生成与溶解的pH列于下表。(已知:偏铝酸钡易溶于水)。以下推断正确的是
氢氧化物 | 溶液pH | |||
开始沉淀 | 完全沉淀 | 沉淀开始溶解 | 沉淀完全溶解 | |
Fe(OH)3 | 2.3 | 3.1 | — | — |
Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |

A. OA段产生的沉淀为:Fe(OH)3和Al(OH)3
B. AB段可能发生的反应是:Al3++3OH-=Al(OH)3↓
C. Al3+的物质的量浓度是2mol·L-1
D. C点沉淀的质量为806g


