题目内容
【题目】298 K时,分别向体积、浓度均为20mL0.1mol·L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示。(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )

A. 298K 时,0.1mol·L-1HX 溶液中HX的电离度为1%
B. V=10mL时,同时微热溶液(忽略体积变化),  逐渐增大
逐渐增大
C. V=20mL 时,HX曲线对应的溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
D. 滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂
【答案】B
【解析】0.1mol·L-1的HX溶液的PH=4, ![]() ,电离的HX 的浓度为10-4,所以298K 时,0.1mol·L-1HX 溶液中HX的电离度为
,电离的HX 的浓度为10-4,所以298K 时,0.1mol·L-1HX 溶液中HX的电离度为![]() 0.1%,故A错误;0.1mol·L-1的HX溶液的PH=4、 0.1mol·L-1HY溶液,PH=1,则HX是弱酸、HY是强酸,加热
0.1%,故A错误;0.1mol·L-1的HX溶液的PH=4、 0.1mol·L-1HY溶液,PH=1,则HX是弱酸、HY是强酸,加热![]() 不变,HX 的电离程度增大,
不变,HX 的电离程度增大, ![]() 增大,所以
增大,所以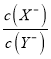 逐渐增大,故B正确;V=20mL 时,HX曲线对应的溶液中溶质恰好是NaX, NaX水解呈碱性,c(Na+)>c(X-)>c(OH-)>c(H+),故C错误;
逐渐增大,故B正确;V=20mL 时,HX曲线对应的溶液中溶质恰好是NaX, NaX水解呈碱性,c(Na+)>c(X-)>c(OH-)>c(H+),故C错误;
氢氧化钠滴定HX是强碱滴定弱酸,恰好中和时呈碱性,只能用酚酞作指示剂,故D错误。

练习册系列答案
相关题目