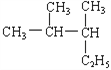
题目内容
【题目】水合肼(N2H4·H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性。将水合肼通入CuO胶体中,可发生如图所示的转化。

(1)图示的转化中,②属于_____________(填“非氧化还原反应”或“氧化还原反应”)。
(2)转化①中,氧化剂与还原剂的物质的量之比为4: l ,则X的化学式为_____。
(3)转化②中,反应一段时间后,溶液中n(OH-)____________(填“增大”“ 减小” 或“不变”)。
(4)若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,④中生成的CuO物质的量也等于0.4mol,则③中参加反应的O2的物质的量与④中今加反应的NaClO的物质的量之比为_________。
【答案】 非氧化还原反应 N2 增大 1:8
【解析】(1)反应②中Cu、N、O化合价均没有变化,发生非氧化还原反应。(2)在反应①中,N2H4做还原剂,CuO做氧化剂;则x为氧化产物,,设X中氮为+a价,氧化剂与还原剂的物质的量之比为4: l ,,有4×(2-1)=1×2×(a-2+2),a=0,则X为氮气。(3)转化②中方程式:Cu2O+4NH3·H2O=2Cu(NH3)2 ++2OH―+3H2O,故溶液中OH― 浓度增大;
(4)在整个转化过程中铜元素守恒,①中参加反应的CuO物质的量为0.4mol,转化后,④中生成的CuO也为0.4mol,反应③4Cu(NH3)2+8NH3+2H2O+O2=4Cu(NH3)42+ +4OH― ,若①中参加反应的CuO物质的量为0.4mol,根据铜元素守恒,参加n[Cu(NH3)2 + ]=0.4mol,参加反应的O2为0.1mol,反应④[Cu(NH3)4]2++ 2ClO―+2OH― =Cu(OH)2 +2N2H4+2Cl―+2H2O,④中参加反应的ClO―=0.8mol,所以③中参加反应的O2的物质的量与④中参加反应的NaClO物质的量之比为1:8。