题目内容
3.在一定浓度的浓硝酸中加入m克铜镁合金恰好完全溶解(假定硝酸的还原产物只有NO2),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到v mL时,恰好完全反应,得到沉淀质量为n克,则下列有关该实验的说法中正确的有( )①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为bv mol
③反应过程中转移的电子数为$\frac{n-m}{17}$mol
④生成NO2气体的体积为$\frac{22.4(n-m)}{17}$L
⑤与合金反应反应的硝酸的物质的量为$\frac{2(n-m)}{17}$mol.
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ①③⑤ | D. | ①②③⑤ |
分析 mg铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO2),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,沉淀质量最大为氢氧化铝和氢氧化镁质量之和,此时溶液为硝酸钠溶液;
①沉淀为氢氧化铝和氢氧化镁,沉淀质量等于铝镁合金质量与氢氧根质量之和;
②恰好溶解后溶液中的NO3-离子的物质的量等于沉淀质量最大溶液中NO3-离子的物质的量,即n(NO3-)=n(Na+)=n(NaOH),据此进行计算;
③根据电荷守恒,在沉淀中,氢氧根的物质的量等于Mg2+、Cu2+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子来进行计算;
④根据气体没有明确所处状态是否标准状态来判断;
⑤根据质量守恒,硝酸有两种作用,作为酸的硝酸(生成硝酸铜、硝酸镁)的物质的量等于$\frac{n-m}{17}$mol,根据电子守恒计算出生成二氧化氮的物质的量,从而可知硝酸的总物质的量.
解答 解:①沉淀为氢氧化铝和氢氧化镁,沉淀质量等于铝镁合金质量与氢氧根质量之和,所以沉淀中氢氧根的质量为(n-m)克,故①正确;
②恰好溶解后溶液中的NO3-离子的物质的量等于沉淀质量最大溶液中NO3-离子的物质的量,当沉淀量最大时,溶液中的溶质只有硝酸钠(NaNO3),硝酸根离子与钠离子的物质的量相等,n(NO3-)=n(Na+)=n(NaOH)=$\frac{bV}{1000}$mol,故②错误;
③至沉淀量最大,生成的n克沉淀为氢氧化铜和氢氧化镁.根据质量守恒定律,其中镁、铜元素的质量等于m克合金的质量,所以沉淀中氢氧根的质量为(n-m)克,在沉淀中,氢氧根的物质的量等于Mg2+、Cu2+所带电荷的物质的量,也等于合金失去电子的物质的量,即为反应过程中转移的电子,n(e-)=n(OH-)=$\frac{n-m}{17}$mol,故③正确;
④选项中没有说明所处状态,无法计算二氧化氮的体积,故④错误;
⑤参加反应的硝酸有两种作用,起酸和氧化剂作用,作氧化剂的硝酸的物质的量等于NO2的物质的量为:$\frac{\frac{n-m}{17}}{5-4}$mol=$\frac{n-m}{17}$mol,生成硝酸铜、硝酸镁的硝酸根离子为为$\frac{n-m}{17}$mol,所以与合金反应的硝酸的物质的量为$\frac{2(n-m)}{17}$mol,故⑤正确;
故①③⑤正确,
故选C.
点评 本题结合铝镁与硝酸反应及生成的盐与氢氧化钠反应的特点,对电子守恒、溶液电中性原理、质量守恒进行综合考查,难度中等,题目以多项形式呈现,考查了学生的综合运用知识能力和解决复杂问题的能力,是一道考查能力的好题.

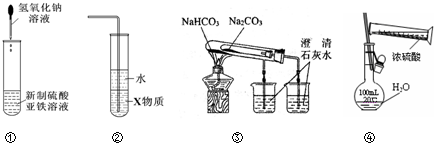
| A. | 利用装置①可制备氢氧化亚铁并长时间观察其颜色 | |
| B. | 装置②中X若为四氯化碳,可用于吸收HCl气体,并防止倒吸 | |
| C. | 装置③验证Na2CO3和NaHCO3两种固体的热稳定性 | |
| D. | 通过④的方法配制一定浓度的稀硫酸溶液 |
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-393.5 kJ/mol | |
| B. | 2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3 kJ | |
| D. | $\frac{1}{2}$C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol |
| A. | HNO3 | B. | H2O2 | C. | KClO3 | D. | Na2O2 |
| A. | 存在的电离有:HCO${\;}_{3}^{-}$+H2O═H2CO3+OH- | |
| B. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c (OH-) | |
| C. | HCO${\;}_{3}^{-}$的电离程度大于HCO${\;}_{3}^{-}$的水解程度 | |
| D. | c(Na+)═c(HCO${\;}_{3}^{-}$)+c (CO${\;}_{3}^{2-}$)+2c(H2CO3) |