题目内容
14.把下列物质中杂质(即括号内物质)除去应选用的试剂(化学式)和对应的化学方程式为:(1)KCl(K2SO4):试剂BaCl2,方程式K2SO4+BaCl2=BaSO4↓+2KCl
(2)FeCl2(CuCl2):试剂Fe,方程式Fe+CuCl2=FeCl2+Cu
(3)Cu(CuO):试剂H2SO4,方程式CuO+H2SO4=CuSO4+H2O
(4)NaHCO5(Na2CO5):试剂CO2,方程式Na2CO3+CO2+H2O=2NaHCO3
(5)Mg(Al):试剂NaOH,方程式2Al+2H2O+2NaOH=2NaAlO2+3H2.
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:(1)要除去KCl中的K2SO4,实质就是除去硫酸根离子,可利用硫酸钾溶液与氯化钡反应生成硫酸钡、氯化钾,能除去杂质且没有引入新的杂质,符合除杂原则,反应的化学方程式为:K2SO4+BaCl2=BaSO4↓+2KCl,
故答案为:BaCl2;K2SO4+BaCl2=BaSO4↓+2KCl;
(2)要除去FeCl2溶液中的CuCl2,实质就是除去铜离子,可利用CuCl2溶液与铁反应生成氯化亚铁和铜,然后过滤即可,能除去杂质且没有引入新的杂质,符合除杂原则,反应的化学方程式为:Fe+CuCl2=FeCl2+Cu,
故答案为:Fe+CuCl2=FeCl2+Cu;
(3)CuO能与稀硫酸反应生成硫酸铜和水,铜不与稀硫酸反应,能除去杂质且没有引入新的杂质,符合除杂原则,反应的化学方程式为:CuO+H2SO4=CuSO4+H2O,
故答案为:CuO+H2SO4=CuSO4+H2O;
(4)溶液中Na2CO3能与CO2、H2O反应生成NaHCO3,NaHCO3与CO2不反应,向Na2CO3中通入二氧化碳,会反应生成碳酸氢钠溶液,达到除杂的目的,反应的化学方程式为:Na2CO3+CO2+H2O=2NaHCO3,
故答案为:Na2CO3+CO2+H2O=2NaHCO3;
(5)镁和碱不反应,铝和碱液反应,所以Mg(Al)加入氢氧化钠,能除去杂质且没有引入新的杂质,符合除杂原则,反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
故答案为:NaOH,2Al+2H2O+2NaOH=2NaAlO2+3H2↑.
点评 本题考查杂质的去除,物质的分离与除杂是高考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键,题目难度中等.

 科学实验活动册系列答案
科学实验活动册系列答案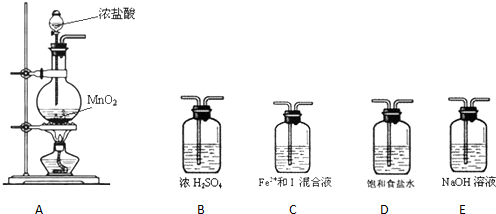
【提出假设】假设1:Fe2+还原性比I-强.假设2:I-还原 性比Fe2+强.假设3:一样强
【验证假设】(1)设计如下几种装置进行实验:
实验 必须的装置是A→C→E(按Cl2气流方向的顺序填写)
(2)实验开始后,控制通入 少量氯气,通过观察混合溶液颜色的变化不能(填“能”或“不能”)判断反应的先后顺序.
(3)请在下表中写出实验步骤及预期现象和结论.
| 实验步骤 | 预期现象和结论 | |
| 取少量反应后的混合溶液分置于A、B两试管中; 往A中滴加KSCN溶液; 往B中滴加淀粉溶液. |
|
【思考与交流】
(5)有同学质疑,上述实验只能验证Cl2分别与Fe2+和I-反应的速率大小,并不能证明Fe2+和I-还原性的强弱.于是提出另一方案:往KI溶液中滴入某溶液,如果能发生反应,即可证明I-的还原性强于Fe2+,该反应的离子方程式是2I-+2Fe3+=I2+2Fe2+.
| A. |  实验室用装置制取氨气 | |
| B. |  装置X若为CCl4,可用于吸收氨气并防止倒吸 | |
| C. |  装置可用于制备氢氧化亚铁并观察其颜色 | |
| D. |  装置是原电池,铁电极为负极,发生氧化反应 |
| A. | 胆矾、漂白粉、氯化钾、硫酸钡 | B. | 盐酸、空气、硝酸、干冰 | ||
| C. | 冰醋酸、海水、氧化铝、乙醇 | D. | 蛋白质、油脂、烧碱、石灰石 |
| A. | 为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值 | |
| B. | 为观察Mg条在CO2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部 | |
| C. | 为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵和稀酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 | |
| D. | 为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂用标准盐酸溶液滴定 |
| A. | v正(CH3OH)=v正(CO2) | B. | 混合气体的密度不变 | ||
| C. | c(CH3OH)=c(H2O) | D. | 混合气体的总物质的量不变 |
| A. | 氧化还原反应中的反应物,不是氧化剂就是还原剂 | |
| B. | 氧化钠是强电解质 | |
| C. | 能导电的物质一定是电解质 | |
| D. | 溶液、胶体这两种分散系的本质区别是否有丁达尔现象 |
