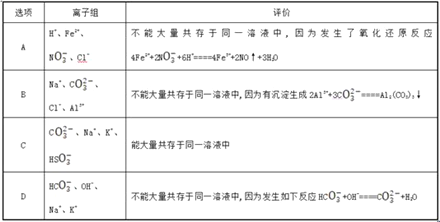
题目内容
【题目】(1)用双线桥法表示反应中电子转移的方向和数目CuO+H2![]() Cu+H2O________________;该反应中,_____元素化合价升高,_____电子,发生氧化反应。_____元素化合价降低,_____电子,发生还原反应。
Cu+H2O________________;该反应中,_____元素化合价升高,_____电子,发生氧化反应。_____元素化合价降低,_____电子,发生还原反应。
(2)用双线桥法表示反应中电子转移的方向和数目2Na+Cl2![]() 2NaCl________________;该反应中,Cl元素化合价______,得到电子,发生______反应。Na元素化合价______,失去电子,发生______反应。
2NaCl________________;该反应中,Cl元素化合价______,得到电子,发生______反应。Na元素化合价______,失去电子,发生______反应。
(3)配平下列氧化还原反应方程式:
①____HNO3![]() ____H2O+____NO2↑+____O2↑;
____H2O+____NO2↑+____O2↑;
②____Cl2+____KOH=____KCl+____KClO3+____H2O。
【答案】 H 失去 Cu 得到
H 失去 Cu 得到 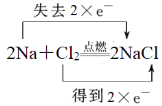 降低 还原 升高 氧化 4HNO3
降低 还原 升高 氧化 4HNO3![]() 2H2O+4NO2↑+O2↑ 3Cl2+6KOH=5KCl+KClO3+3H2O
2H2O+4NO2↑+O2↑ 3Cl2+6KOH=5KCl+KClO3+3H2O
【解析】
双线桥法表示元素的原子在化学反应前后电子的得失和数目,结合反应中元素的化合价变化情况、氧化还原反应的有关概念结合电子得失守恒和原子守恒分析解答。
(1)反应中铜元素化合价从+2价降低到0价,得到2个电子,被还原,发生还原反应;氢元素化合价从0价升高到+1价,失去1个电子,被氧化,发生氧化反应,根据电子得失守恒可知反应中转移2个电子,则用双线桥法表示反应中电子转移的方向和数目为 ,故答案为:
,故答案为: ;H;失去;Cu;得到;
;H;失去;Cu;得到;
(2)反应中氯元素化合价从0价降低到-1价,得到1个电子,被还原,发生还原反应;钠元素化合价从0价升高到+1价,失去1个电子,被氧化,发生氧化反应,根据电子得失守恒可知反应中转移2个电子,则用双线桥法表示反应中电子转移的方向和数目为 ,故答案为:
,故答案为: ;降低;还原;升高;氧化;
;降低;还原;升高;氧化;
(3)①反应中氮元素化合价从+5价降低到+4价,得到1个电子,氧元素化合价从-2价升高到0价,失去2个电子,则根据电子得失守恒和原子守恒可知反应的方程式为4HNO3![]() 2H2O+4NO2↑+O2↑;
2H2O+4NO2↑+O2↑;
②反应中氯元素化合价部分从0价升高到+5价,部分降低到-1价,则根据得失电子守恒和原子守恒可知反应的方程式为3Cl2+6KOH=5KCl+KClO3+3H2O。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案