题目内容
【题目】下列评价及离子方程式书写正确的是 ( )
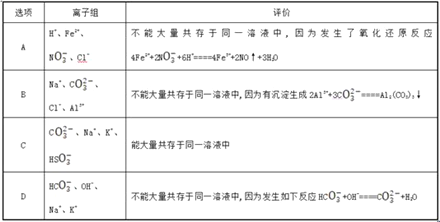
A. A B. B C. C D. D
【答案】D
【解析】分析:A.硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子,评价中的离子方程式不满足电子守恒;B.碳酸根离子与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;C.碳酸氢根离子能够与偏铝酸根离子反应生成氢氧化铝沉淀和碳酸根离子;D.碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水。
详解:A.NO3-、H+具有强氧化性,能够与Fe2+发生氧化还原反应,在溶液中不能大量共存,离子方程式书写错误,正确的离子方程式为:3Fe2++ NO3-+4H+═3Fe3++NO↑+2H2O,故A错误;
B.CO32-、Al3+之间发生反应生成氢氧化铝沉淀和二氧化碳气体,评价中离子方程式书写错误,正确的离子方程式为:2 Al3+ +6H2O +3CO32-═2Al(OH)3↓+3CO2↑,故B错误;
C.AlO2-、HCO3-之间反应生成氢氧化铝沉淀,反应的离子方程式为: AlO2-+ H2O +HCO3-= Al(OH)3↓+3CO32-,在溶液中不能大量共存,评价错误,故C错误;
D. HCO3-、OH-之间反应生成碳酸根离子和水,反应的离子方程式为: HCO3-+OH-═CO32-+ H2O,在溶液中不能大量共存,评价合理,所以D选项是正确的;因此本题选D。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】某实验小组同学设计实验,完成了![]() 和
和![]() 溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究。
溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究。
实验I:
| 实验现象 |
i.加入 ii.取少量i中清液于试管中,滴加2滴1 mol/L |
已知:i.![]()
ii.![]() 的性质与卤素单质相似,且氧化性:
的性质与卤素单质相似,且氧化性:![]()
(1)![]() 和
和![]() 溶液反应的离子方程式是______。
溶液反应的离子方程式是______。
(2)现象ii中溶液最终呈红色的一种可能原因是:![]() 和
和![]() 生成(SCN)2,进而使清液中的
生成(SCN)2,进而使清液中的![]() 氧化为
氧化为![]() 。设计如下实验II进行验证:
。设计如下实验II进行验证:

① 认为原因被证实的现象iii是________。
② 加入CuCl2溶液后反应的离子方程式是_________。
(3)有的同学认为实验II并不严谨,不能证实(2)中猜想,改进的实验III如下:

① 对比实验II,说明实验III更加严谨的原因:________。
② 改进后的实验才能证实(2)中猜想,依据的上述现象是______。
(4)改变实验I的试剂添加顺序及用量,设计实验IV:
实验IV | 现象 |
向2 mL 1 mol/L | 充分振荡,溶液红色褪去,有白色沉淀生成 |
① 实验IV中溶液红色褪去,不能说明![]() 反应完全。结合实验II或III,说明理由:_______。
反应完全。结合实验II或III,说明理由:_______。
②实验小组同学进行讨论,设计了下列实验方案,能够检测红色褪去后的溶液是否含有![]() 的是_______(填序号)。
的是_______(填序号)。
a.排除溶液中的![]() 后,再加入足量
后,再加入足量![]() 溶液进行检测
溶液进行检测
b.排除溶液中的![]() 后,再加入足量
后,再加入足量![]() 溶液进行检测
溶液进行检测
c.选择一种只与![]() 反应的试剂,观察是否出现特征现象
反应的试剂,观察是否出现特征现象