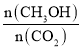题目内容
【题目】汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
I.已知4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)H=﹣1200kJmol﹣1
4CO2(g)+N2(g)H=﹣1200kJmol﹣1
(1)该反应在___(填“高温、低温或任何温度”)下能自发进行。
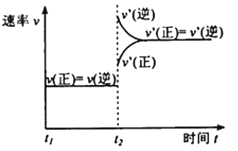
(2)对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是___(填标号)。

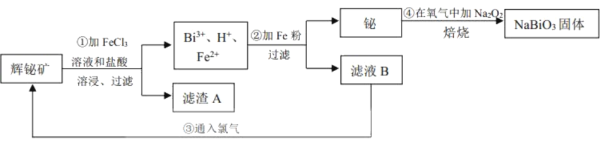
(3)某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲:NO2 0.2mol,CO 0.4mol;乙:NO2 0.1mol,CO 0.2mol。
经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲___乙(填“>、=、<或不确定”,下同)。
②NO2的平衡浓度:甲___乙。
③甲中CO的转化率为50%,该反应的平衡常数为___。
II.柴油汽车尾气中的碳烟(C)和NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。

模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | 一定量 |
(4)375℃时,测得排出的气体中含amol O2和0.0525 mol CO2,已知X为N2,Y为N2O,则a=___。
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是___。
【答案】低温 CD > > 10L/mol 0.45 NO2气体中有N2O4,不便进行定量测定
【解析】
根据化学反应的复合判据判断反应能否自发进行;根据影响化学平衡的因素判断图像的正确;根据平衡转化率计算化学平衡常数,根据图像和守恒法计算。
Ⅰ.已知4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol1
(1)ΔH=-1200 kJ·mol1<0,正反应为气体体积减小的过程,即为熵减的过程,ΔS<0,结合复合判据ΔH-TΔS<0反应能自发进行,则该反应在低温时能自发进行;
(2)A.T1>T2,由T1到T2为降温,反应速率应减小,图像与实际不符,故A错误;
B.利用“先拐先平数值大”的原则,根据图中显示可得T1<T2,图像与实际不符,故B错误;
C.增大压强平衡向体积减小的方向移动,即向正反应方向移动,CO2的体积分数增大;保持压强不变,降低温度,平衡向放热的方向移动,即向正反应方向移动,CO2的体积分数增大,图像与实际相符合,故C正确;
D.平衡常数只与温度有关,改变压强平衡常数不变,图像与实际相符合,故D正确;
答案选CD;
(3) ①甲的投料是乙的两倍,乙相当于在甲达到平衡后减小压强使容器的体积变为4L,减小压强平衡逆向移动,则甲中N2的平衡体积分数大于乙;
②甲的投料是乙的两倍,乙相当于在甲达到平衡后减小压强使容器的体积变为4L,若平衡不移动则乙中NO2浓度为甲中的一半,减小压强虽然平衡逆向移动,根据勒夏特列原理,甲中NO2的平衡浓度大于乙;
③设甲中达到平衡状态时CO的变化物质的量为x ,则![]() =50%,可得x=0.2mol,
=50%,可得x=0.2mol,
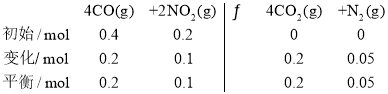
则该反应的平衡常数K=![]() =
=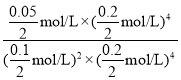 =10L/mol;
=10L/mol;
Ⅱ(4)模拟尾气中含NO0.025mol,X为N2,Y为N2O,根据图示NO转化为N2的转化率为16%,转化为N2O的转化率为8%,根据N守恒,则排出的气体中N2物质的量为0.025mol×16%÷2=0.002mol、N2O物质的量为0.025mol×8%÷2=0.001mol,排出的气体中有0.0525molCO2,根据得失电子守恒,0.002mol×2×2+0.001mol×2×1+4n(O2)消耗=0.0525mol×4,解得n(O2)消耗=0.05mol,则排出的气体中含O2物质的量为0.5mol-0.05mol=0.45mol,即a=0.45。
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是:NO2中存在2NO2![]() N2O4的平衡体系,NO2气体中存在N2O4,不便于定量测定。
N2O4的平衡体系,NO2气体中存在N2O4,不便于定量测定。

 阅读快车系列答案
阅读快车系列答案