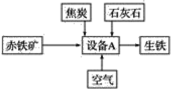
题目内容
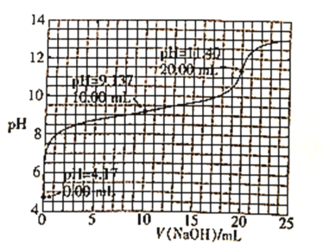
【题目】已知H3BO3是一元酸,室温时,用1.0mol·L-1的NaOH溶液滴定25.00mL H3BO3溶液的曲线如图所示:
下列说法正确的是( )
A.可用酚酞作滴定指示剂
B.起始时H3BO3的浓度为0.8mol·L-1
C.H3BO3的电离常数数量级为10-5
D.滴定至pH=12时,溶液中:c(OH-)<c(H3BO3)+c(H+)
【答案】B
【解析】
由图像可知当NaOH溶液体积为20mL时,溶液的pH发生突变,此时的反应按化学计量数之比反应,从而可算出H3BO3的浓度,根据起点进一步判断出该酸的强弱和计算出其电离平衡常数。pH=12时,根据电荷守恒和物料守恒可判断溶液中离子浓度的大小关系。
A. 酚酞的变色范围为8~10,由图可知NaOH滴定H3BO3时pH在11.40左右才发生突变,酚酞的变色范围不在pH 的突变范围内,故不能用酚酞作指示剂,A错误;
B. 由分析可知当NaOH加入的体积为20mL时,酸碱恰好完全反应,且H3BO3为一元酸,故n(NaOH)=n(H3BO3),20mL×1mol/L=25mL×c(H3BO3),解得c(H3BO3)=0.8mol/L,B正确;
C. 根据曲线的起点可知H3BO3电离出的H+浓度为10-4.17mol/L,则电离出的B(OH)4-的浓度也为10-4.17mol/L,平衡时H3BO3的浓度为0.8mol/L-10-4.17mol/L≈0.8mol/L,所以K=(10-4.17)2÷0.8=5.7×10-9,数量级为10-9,C错误;
D. 当pH=12时,加入的NaOH的物质的量大于H3BO3的物质的量,
故有c(Na+)>c[B(OH)4-]+c(H3BO3),再根据电荷守恒有c(Na+)+c(H+)= c[B(OH)4-]+c(OH-),联立上述两个式子可得c(OH-)>c(H3BO3)+c(H+),D错误;
答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
I.已知4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g)H=﹣1200kJmol﹣1
4CO2(g)+N2(g)H=﹣1200kJmol﹣1
(1)该反应在___(填“高温、低温或任何温度”)下能自发进行。
(2)对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是___(填标号)。

(3)某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料。甲:NO2 0.2mol,CO 0.4mol;乙:NO2 0.1mol,CO 0.2mol。
经过一段时间后达到平衡状态。
①N2的平衡体积分数:甲___乙(填“>、=、<或不确定”,下同)。
②NO2的平衡浓度:甲___乙。
③甲中CO的转化率为50%,该反应的平衡常数为___。
II.柴油汽车尾气中的碳烟(C)和NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。

模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | 一定量 |
(4)375℃时,测得排出的气体中含amol O2和0.0525 mol CO2,已知X为N2,Y为N2O,则a=___。
(5)实验过程中采用NO模拟NOx,而不采用NO2的原因是___。