题目内容
2.下列物质在水溶液中,能电离出硫离子的是( )| A. | Na2S | B. | NaHSO4 | C. | SO2 | D. | H2SO4 |
分析 在水溶液中能电离出硫离子的物质为可溶性硫化物或H2S,据此分析解答.
解答 解:A.Na2S为强电解质,在水溶液中电离方程式为Na2S=2Na++S2-,能电离出硫离子,故A正确;
B.硫酸氢钠在水溶液中电离方程式为NaHSO4=Na++H++SO42-,不能电离出硫离子,故B错误;
C.二氧化硫和水反应生成亚硫酸,亚硫酸是二元弱酸,在水溶液中分步电离,涉及的反应方程式为SO2+H2O=H2SO3、H2SO3?H++HSO3-、HSO3-?H++SO32-,所以没有硫离子生成,故C错误;
D.硫酸在水溶液中电离方程式为H2SO4=2H++SO42-,没有硫离子生成,故D错误;
故选A.
点评 本题考查电解质在水溶液中的电离,明确电解质强弱及物质构成是解本题关键,注意硫酸氢钠在水溶液中或熔融状态下电离方式区别,题目难度不大.

练习册系列答案
相关题目
12.温度相同、浓度均为0.2mol L-1的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
| A. | ③①④②⑤ | B. | ①③④②⑤ | C. | ③②①④⑤ | D. | ⑤②④①③ |
10.下列有关化学实验基本知识和基本操作的描述不正确的是( )
| A. | 丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 过滤和蒸发操作均用到玻璃棒,但玻璃棒的作用不相同 | |
| C. | 加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- | |
| D. | 氨气能使湿润的红色石蕊试纸变蓝,说明氨气的水溶液呈碱性 |
14.现有甲、乙、丙三种元素,其原子序数都不超过20.有关信息如下:
下列关于甲、乙、丙三种元素相关的分析正确的是( )
| 元素代号 | 相关信息 |
| 甲 | n为电子层数,甲原子最外层电子数为(2n2-1) |
| 乙 | 在周期表中它的周期数为k,主族序数为(2k+1) |
| 丙 | 电子层数大于最外层电子数 |
| A. | 甲的单质难溶于水 | |
| B. | 乙的气态氢化物遇湿润的pH试纸变红色或蓝色 | |
| C. | 丙的最高价氧化物对应的水化物是强碱 | |
| D. | 甲、丙只能形成共价化合物 |
10.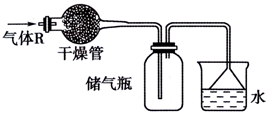 实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )
实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )
 实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )
实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )| A. | NO | B. | HCl | C. | O2 | D. | NH3 |
11.下列说法正确的是( )
| A. | 化学平衡状态是反应的最大限度,此时反应停止了 | |
| B. | 水通电时能分解成氢气和氧气,氢气和氧气点燃能生成水,这两个反应是可逆反应 | |
| C. | 可逆反应的化学方程式中,用可逆号代替等号 | |
| D. | 当温度或浓度改变时,原来的化学平衡一定不被破坏 |