题目内容
【题目】太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等元素组成的化学物质。
(1)钙原子基态时的电子排布式为___________,金属钴堆积方式与镁相似,都属于六方最密堆积,其配位数是___________。
(2)氮元素的第一电离能在同周期中(稀有气体除外)从大到小排第___________位;写出与NO3-互为等电子体的一种非极性分子的化学式___________。
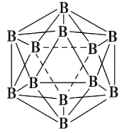
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),其中有两个原子为10B,其余为11B,则该结构单元有___________种不同的结构类型。已知硼酸(H3BO3)为一元弱酸,解释其为一元弱酸的原因____________________________________________。硼酸的结构与石墨相似,层内的分子以氢键相连,含lmol硼酸的晶体中有___________mol氢键。
(4)硒是动物体必需的营养元素。SeO2是硒的重要化合物,SeO2的价层电子对互斥模型是___________。
(5)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为1︰5,则该配离子的化学式为___________。
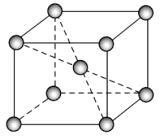
(6)钴晶体的一种晶胞是一种体心立方结构(如图所示),若该晶胞的边长为am,密度为ρg/cm3,NA表示阿伏加德罗常数的值,则钴的相对原子质量可表示为___________。
【答案】1s22s22p63s23p64s2或[Ar]4s2 12 2 SO3、BF3等 3 硼酸与1个水分子可以形成1个氢键,电离产生![]() 和1个H+,因此硼酸为一元酸 3 平面三角形
和1个H+,因此硼酸为一元酸 3 平面三角形 ![]()
![]()
【解析】
(1)钙为20号元素,其原子核外有20个电子,根据构造原理可知其基态原子核外电子排布为:1s22s22p63s23p64s2或[Ar]4s2, 镁晶体属于六方最密堆积,因为Co堆积方式与镁相似,所以其配位数是12;
(2)同一周期中元素的第一电离能,随着原子序数的增加而呈增加趋势,N由于2p半满的关系,氮元素的第一电离能比氧元素的第一电离能大,所以,F>N>O,N排在第二位;等电子体意味着原子数目和价电子数目相同,那么与NO3-互为等电子体的非极性分子为SO3、BF3等;
(3) 晶体硼的结构单元是正二十面体,有两个10B,先将一个10B固定在上顶点,则第二个10B依次为靠近一层的顶点、远离一层的顶点、对位顶点,有3种结构;硼酸与1个水分子可以形成1个氢键,电离产生![]() 和1个H+,因此硼酸为一元酸;1个硼酸分子中可以形成6个氢键,但是每个氢键是2个硼酸分子共有,所以每个硼酸分子平均含有3个氢键,则1mol硼酸晶体中含有3mol氢键;
和1个H+,因此硼酸为一元酸;1个硼酸分子中可以形成6个氢键,但是每个氢键是2个硼酸分子共有,所以每个硼酸分子平均含有3个氢键,则1mol硼酸晶体中含有3mol氢键;
(4) SeO2分子中价层电子对数为![]() (6-2×2)+2=3,SeO2的价层电子互斥模型为平面三角形;
(6-2×2)+2=3,SeO2的价层电子互斥模型为平面三角形;
(5) 在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为1︰5,配体为1个Cl-和5个H2O,其他的为外界,则配离子的化学式为:![]() ;
;
(6) 相对原子质量,在数值上等于摩尔质量(以g/mol为单位),该晶胞中原子个数1+8×1/8=2,晶胞体积为(a×10-7cm)3,根据![]() ,则
,则 ![]() 。
。
(1)钙为20号元素,其原子核外有20个电子,可知其基态原子核外电子排布为:1s22s22p63s23p64s2或[Ar]4s2,镁晶体属于六方最密堆积,因为Co堆积方式与镁相似,所以其配位数是12;
(2) N由于2p半满的关系,氮元素的第一电离能比氧元素的第一电离能大,所以,F>N>O,N排在第二位;等电子体意味着原子数目和价电子数目相同,那么与NO3-互为等电子体的非极性分子为SO3、BF3等;
(3) 晶体硼的结构单元是正二十面体,有两个10B,先将一个10B固定在上顶点,则第二个10B依次为靠近一层的顶点、远离一层的顶点、对位顶点,有3种结构;硼酸与1个水分子可以形成1个氢键,电离产生![]() 和1个H+,因此硼酸为一元酸;1个硼酸分子中可以形成6个氢键,但是每个氢键是2个硼酸分子共有,所以每个硼酸分子平均含有3个氢键,则1mol硼酸晶体中含有3mol氢键;
和1个H+,因此硼酸为一元酸;1个硼酸分子中可以形成6个氢键,但是每个氢键是2个硼酸分子共有,所以每个硼酸分子平均含有3个氢键,则1mol硼酸晶体中含有3mol氢键;
(4) SeO2分子中价层电子对数为![]() (6-2×2)+2=3,SeO2的价层电子互斥模型为平面三角形;;
(6-2×2)+2=3,SeO2的价层电子互斥模型为平面三角形;;
(5)配位数为6,组成为TiCl3·6H2O的晶体,两种配体的物质的量之比为1︰5,配体为1个Cl-和5个H2O,其他的为外界,则配离子的化学式为:![]() ;
;
(6) 相对原子质量,在数值上等于摩尔质量(以g/mol为单位),该晶胞中原子个数1+8×1/8=2,晶胞体积为(a×10-7![]() ,则
,则 ![]() ,Co的相对原子质量为5a3ρNA×10-22。
,Co的相对原子质量为5a3ρNA×10-22。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案