题目内容
【题目】为测定![]() 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用![]() 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
序号 | 滴定前读数/mL | 滴定终点读数/mL |
1 | 0.00 | 19.98 |
2 | 1.26 | 22.40 |
3 | 1.54 | 21.56 |
已知:![]()
假设杂质不参加反应。
该样品中![]() 的质量分数是________%(保留小数点后一位);
的质量分数是________%(保留小数点后一位);
写出简要计算过程:________。
【答案】95.2 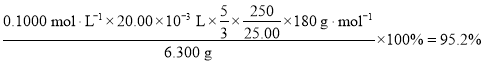
【解析】
根据方程式找出MnO4-和![]() 之间的数量关系,然后进行计算求解;
之间的数量关系,然后进行计算求解;
第一次所用标准液为:19.98mL,第二次所用标准液为22.40-1.26=20.14mL,第三次所用标准液为:21.56-1.54=20.02mL,第二次数据偏差较大舍去,所以所用标准液的体积为![]() ;根据方程式可知反应中存在数量关系:3MnO4-~5
;根据方程式可知反应中存在数量关系:3MnO4-~5![]() ,所以25mL待测液中所含
,所以25mL待测液中所含![]() 的物质的量为:
的物质的量为:![]() ,质量为
,质量为![]() ,所以样品中
,所以样品中![]() 质量分数为
质量分数为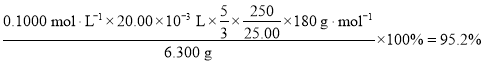 。
。

【题目】一定温度下,在2L的恒容密闭容器中发生反应A(g)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示:
3C(g)。反应过程中的部分数据如下表所示:
n/mol t/min | n(A) | n(B) | n(C) |
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5min用A表示的平均反应速率为0.09mol·L-1·min-1
B.该反应在10min后才达到平衡
C.物质B的平衡转化率为20%
D.平衡状态时,c(C)=0.6mol·L-1
【题目】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是___________。
(2)“酸浸氧化”中,VO+和VO2+被氧化成![]() ,同时还有___________离子被氧化。写出VO+转化为
,同时还有___________离子被氧化。写出VO+转化为![]() 反应的离子方程式___________。
反应的离子方程式___________。
(3)“中和沉淀”中,钒水解并沉淀为![]() ,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
(4)“沉淀转溶”中,![]() 转化为钒酸盐溶解。滤渣③的主要成分是___________。
转化为钒酸盐溶解。滤渣③的主要成分是___________。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________。