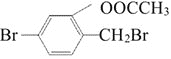
题目内容
【题目】J、L、M、R、T 是原子序数依次增大的短周期主族元素,J、R 在周期表中的相对位置如表; J 原子最外层电子数是其内层电子数的 2 倍;L 的最简单气态氢化物甲的水溶液显碱性;M 是地壳中含量最多的金属元素。

(1)M 的离子结构示意图为_______;元素 T 在周期表中位于第________周期第_______族。
(2)J 元素是_________(用元素符号表示);J 和氢组成的 10 电子化合物的化学式为_________。
(3)M 和 T 形成的化合物属于_______(填“离子化合物”、或“共价化合物”),其中所有原 子都满足最外层 8 电子结构的分子是_______(填化学式),电子式为_______。
(4)元素 M 形成的简单离子的水溶液与甲的水溶液反应的离子方程式_______。
【答案】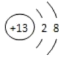 第三周期 第ⅦA 族 C CH4 共价化合物 CCl4
第三周期 第ⅦA 族 C CH4 共价化合物 CCl4  Al3++3NH3H2O=Al(OH)3↓+3NH4+
Al3++3NH3H2O=Al(OH)3↓+3NH4+
【解析】
J、L、M、R、T是原子序数依次增大的短周期主族元素,J原子最外层电子数是其内层电子数的 2 倍,则J为碳元素,由J、R在周期表中的相对位置,可知R为硫元素;L的最简单气态氢化物甲的水溶液显碱性,则L为氮元素、甲为氨气;M是地壳中含量最多的金属元素,则M为Al元素,T的原子序数最大的,则为Cl元素,据此解答。
(1)M为Al元素,Al3+离子结构示意图为 ;Cl元素在周期表中位于第三周期第ⅦA族;
;Cl元素在周期表中位于第三周期第ⅦA族;
(2)J是C元素,和氢组成的10电子化合物的化学式为CH4;
(3)M和T形成的化合物为AlCl3,属于共价化合物,其中所有原子都满足最外层 8 电子结构的分子是CCl4,电子式为 ;
;
(4)Al3+离子的水溶液与氨气的水溶液反应的离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+。

【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液 2Cl-+2H2O | 用惰性电极电解MgBr2溶液 2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-=H2O |
A.AB.BC.CD.D