题目内容
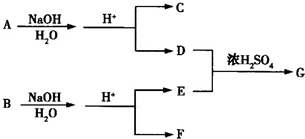
化合物A、B均是分子式为C8H8O3的无色液体,均难溶于水.从A、B开始,可发生图示的一系列反应(反应中的无机物已部分略去),E的苯环上的一元硝基化物只有两种,K可发生银镜反应.

(1)写出A和K的结构简式:A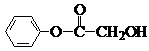
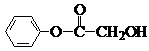 K
K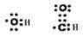
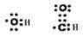 .
.
(2)上图a-i的反应中,属于酯化反应的有
(3)写出反应a的化学方程式是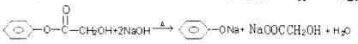
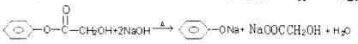 .
.
(4)已知CH3COONa+NaOH
CH4↑+Na2CO3,请完成E→D的反应方程式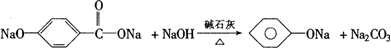
 .
.
(5)实验室配制银氨溶液的主要操作是
(6)芒香族化合物W与A互为同分异构体且满足以下条件:①1molW能与含3molNaOH
的溶液恰好反应,②苯环上不直接连甲基,则符合上述条件的W的同分异构体有

(1)写出A和K的结构简式:A
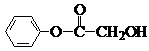
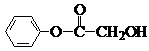
HCOOCH3
HCOOCH3
;X与K互为同分异构体且也可发生银镜反应,则X所含官能团的为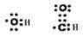
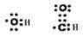
(2)上图a-i的反应中,属于酯化反应的有
e、i
e、i
(填字母)(3)写出反应a的化学方程式是
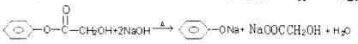
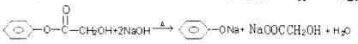
(4)已知CH3COONa+NaOH
| ||
| 高温 |


(5)实验室配制银氨溶液的主要操作是
在洁净的试管里加入1mL2%的硝酸银溶液,然后一边摇动试管一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好完全溶解为止,即配得银氨溶液
在洁净的试管里加入1mL2%的硝酸银溶液,然后一边摇动试管一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好完全溶解为止,即配得银氨溶液
写出K与银氨溶液反应的离子方程式为HCOOCH3+2Ag(NH3)2++2OH-
CH3OH+CO32-+2NH4++2Ag↓+2NH3
| △ |
HCOOCH3+2Ag(NH3)2++2OH-
CH3OH+CO32-+2NH4++2Ag↓+2NH3
| △ |
(6)芒香族化合物W与A互为同分异构体且满足以下条件:①1molW能与含3molNaOH
的溶液恰好反应,②苯环上不直接连甲基,则符合上述条件的W的同分异构体有
10
10
种.分析:从正向看,A在碱性条件下能发生水解,应是酯,它在碱性条件下水解生成羧酸盐和醇,根据生成的六元环状酯,说明丁中既含有羧基,又含有羟基,应为HOCH2COOH,从逆向生成K的条件看,可推知K也是酯,由K可发生银镜反应,所以可推知F是甲醇,G应是甲酸.H能与溴水反应生成白色沉淀,则H应为苯酚,D在酸性条件下生成H进一步可推知D为苯酚钠,E为含酚羟基的苯甲酸盐,E的苯环上的一元硝基化物只有两种,说明两个取代基位于对位位置,可推知A的可能结构简式为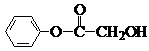 ,B的结构简式为
,B的结构简式为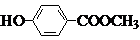 ,并以此书写有关化学方程式,结合有机物的结构和性质以及题目要求可解答该题.
,并以此书写有关化学方程式,结合有机物的结构和性质以及题目要求可解答该题.
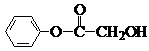 ,B的结构简式为
,B的结构简式为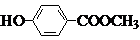 ,并以此书写有关化学方程式,结合有机物的结构和性质以及题目要求可解答该题.
,并以此书写有关化学方程式,结合有机物的结构和性质以及题目要求可解答该题.解答:解:从正向看,A在碱性条件下能发生水解,应是酯,它在碱性条件下水解生成羧酸盐和醇,根据生成的六元环状酯,说明丁中既含有羧基,又含有羟基,应为HOCH2COOH,从逆向生成K的条件看,可推知K也是酯,由K可发生银镜反应,所以可推知F是甲醇,G应是甲酸.H能与溴水反应生成白色沉淀,则H应为苯酚,D在酸性条件下生成H进一步可推知D为苯酚钠,E为含酚羟基的苯甲酸盐,E的苯环上的一元硝基化物只有两种,说明两个取代基位于对位位置,可推知A的可能结构简式为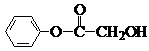 ,B的结构简式为
,B的结构简式为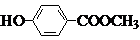 ,
,
(1)有以上分析可知A为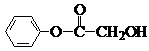 ,K为HCOOCH3,X与K互为同分异构体且也可发生银镜反应,则X应含有-CHO和-OH,可能结构为HO-CH2-CHO,电子式为
,K为HCOOCH3,X与K互为同分异构体且也可发生银镜反应,则X应含有-CHO和-OH,可能结构为HO-CH2-CHO,电子式为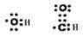 ,
,
故答案为: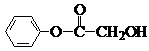 ;HCOOCH3;
;HCOOCH3;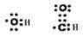 ;
;
(2)上图a-i的反应中,属于酯化反应的有e和i,故答案为:e、i;
(3)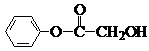 在碱性条件下发生水解,反应的方程式为
在碱性条件下发生水解,反应的方程式为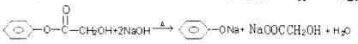 ,
,
故答案为: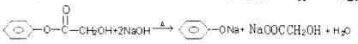 ;
;
(4)B的结构简式为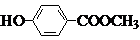 ,水解生成
,水解生成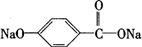 ,可与NaOH在加热条件下反应生成苯酚钠,反应类似于乙酸钠和NaOH反应生成甲烷的反应,反应的方程式为
,可与NaOH在加热条件下反应生成苯酚钠,反应类似于乙酸钠和NaOH反应生成甲烷的反应,反应的方程式为 ,
,
故答案为: ;
;
(5)实验室配制银氨溶液时,在洁净的试管里加入1mL2%的硝酸银溶液,然后一边摇动试管一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好完全溶解为止,即配得银氨溶液,K为HCOOCH3,含有-CHO,可与银氨溶液反应,反应的方程式为HCOOCH3+2Ag(NH3)2++2OH-
CH3OH+CO32-+2NH4++2Ag↓+2NH3,注意银氨溶液呈碱性,同时促使酯类水解生成甲醇,
故答案为:在洁净的试管里加入1mL2%的硝酸银溶液,然后一边摇动试管一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好完全溶解为止,即配得银氨溶液;HCOOCH3+2Ag(NH3)2++2OH-
CH3OH+CO32-+2NH4++2Ag↓+2NH3,
(6)A为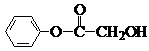 ,芒香族化合物W与A互为同分异构体且满足以下条件:①1molW能与含3molNaOH的溶液恰好反应,②苯环上不直接连甲基,则符合上述条件的W的同分异构体有3个取代基,其中有2个-OH,另一个为-CH2COOH或-CH2OOCH,各有5种同分异构体,如图
,芒香族化合物W与A互为同分异构体且满足以下条件:①1molW能与含3molNaOH的溶液恰好反应,②苯环上不直接连甲基,则符合上述条件的W的同分异构体有3个取代基,其中有2个-OH,另一个为-CH2COOH或-CH2OOCH,各有5种同分异构体,如图 X为-CH2COOH或-CH2OOCH,2个-OH可在
X为-CH2COOH或-CH2OOCH,2个-OH可在
1,2;1,3;1,4;1,5;2,3等5种位置,共10种,
故答案为:10.
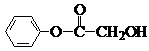 ,B的结构简式为
,B的结构简式为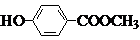 ,
,(1)有以上分析可知A为
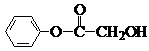 ,K为HCOOCH3,X与K互为同分异构体且也可发生银镜反应,则X应含有-CHO和-OH,可能结构为HO-CH2-CHO,电子式为
,K为HCOOCH3,X与K互为同分异构体且也可发生银镜反应,则X应含有-CHO和-OH,可能结构为HO-CH2-CHO,电子式为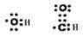 ,
,故答案为:
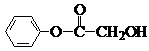 ;HCOOCH3;
;HCOOCH3;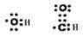 ;
;(2)上图a-i的反应中,属于酯化反应的有e和i,故答案为:e、i;
(3)
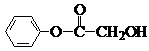 在碱性条件下发生水解,反应的方程式为
在碱性条件下发生水解,反应的方程式为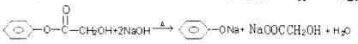 ,
,故答案为:
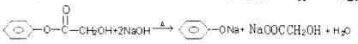 ;
;(4)B的结构简式为
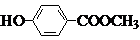 ,水解生成
,水解生成 ,可与NaOH在加热条件下反应生成苯酚钠,反应类似于乙酸钠和NaOH反应生成甲烷的反应,反应的方程式为
,可与NaOH在加热条件下反应生成苯酚钠,反应类似于乙酸钠和NaOH反应生成甲烷的反应,反应的方程式为 ,
,故答案为:
 ;
;(5)实验室配制银氨溶液时,在洁净的试管里加入1mL2%的硝酸银溶液,然后一边摇动试管一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好完全溶解为止,即配得银氨溶液,K为HCOOCH3,含有-CHO,可与银氨溶液反应,反应的方程式为HCOOCH3+2Ag(NH3)2++2OH-
| △ |
故答案为:在洁净的试管里加入1mL2%的硝酸银溶液,然后一边摇动试管一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好完全溶解为止,即配得银氨溶液;HCOOCH3+2Ag(NH3)2++2OH-
| △ |
(6)A为
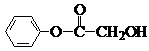 ,芒香族化合物W与A互为同分异构体且满足以下条件:①1molW能与含3molNaOH的溶液恰好反应,②苯环上不直接连甲基,则符合上述条件的W的同分异构体有3个取代基,其中有2个-OH,另一个为-CH2COOH或-CH2OOCH,各有5种同分异构体,如图
,芒香族化合物W与A互为同分异构体且满足以下条件:①1molW能与含3molNaOH的溶液恰好反应,②苯环上不直接连甲基,则符合上述条件的W的同分异构体有3个取代基,其中有2个-OH,另一个为-CH2COOH或-CH2OOCH,各有5种同分异构体,如图 X为-CH2COOH或-CH2OOCH,2个-OH可在
X为-CH2COOH或-CH2OOCH,2个-OH可在1,2;1,3;1,4;1,5;2,3等5种位置,共10种,
故答案为:10.
点评:本题考查有机物的推断,题目难度较大,本题注意以丁和K为解答该题的突破口进行推断,易错点为(6),注意同分异构体的判断.

练习册系列答案
相关题目


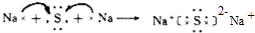
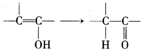
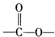 基团.
基团.