题目内容
【题目】某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
沉淀物 | Fe3+ | Al3+ | Mg2+ |
PH | 3.2 | 5.2 | 12.4 |
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(2)滤渣I的主要成分有 。
(3)从滤液Ⅱ中可回收利用的主要物质有 。
(4)若将MgCl2溶液加热蒸干得到的固体是__________,若要得到MgCl2应采取的操作是___________。
(5)用稀硫酸酸浸时形成滤渣的离子方程式有_____________________。
【答案】(1)升高温度、搅拌、多次浸取等(2分)
(2)Fe(OH)3 Al(OH)3(2分) (3)Na2SO4(1分)
(4) Mg(OH)2(1分) 在HCl的气流中将MgCl2溶液加热蒸干(2分)
(5) MgSiO3+2H+=H2SiO3+Mg2+ (2分)CaMg(CO3)2+SO42-+4H+=CaSO4+Mg2++2CO2↑+2H2O(2分)
【解析】
试题分析:(1)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率;
(2)因MgCO3、CaMg(CO3)2、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、CaSO4、Al2(SO4)3和Fe2(SO4)3,其中CaSO4微溶,形成滤渣;滤液中含有MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3 Al(OH)3;
(3)上述过滤后滤液中阴离子主要是SO42-,加入NaOH后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是Na2SO4;
(4)氯化镁水解生成氢氧化镁和氯化氢,水解吸热,且生成的氯化氢易挥发,因此若将MgCl2溶液加热蒸干得到的固体是氢氧化镁。要得到氯化镁应采取的操作是在HCl的气流中将MgCl2溶液加热蒸干;
(5)由于硅酸镁与稀硫酸反应生成硅酸沉淀,另外硫酸钙微溶,所以用稀硫酸酸浸时形成滤渣的离子方程式有MgSiO3+2H+=H2SiO3+Mg2+、CaMg(CO3)2+SO42-+4H+=CaSO4+Mg2++2CO2↑+2H2O。

 小学课时特训系列答案
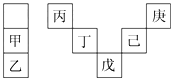
小学课时特训系列答案【题目】A、B、C、D、E、F是六种常见元素,其中A、B、C、D、E五种元素在周期表中的相对位置如下图所示:
A | B | |||||
C | D | E |
其中B、F形成的二元化合物与D的单质在高温条件下能发生置换反应,该反应可用于焊接铁轨。
回答下列问题:
(1)E在元素周期表中的位置 。
(2)B、C两种元素形成的既含离子键又含共价键的化合物的电子式 。
(3)工业上制备D的单质的方法是电解其 (填字母),阴极反应式为 。
a.氧化物 b.氢氧化物 c.氯化物 d.硫酸盐
(4)常温条件下,向20ml浓度为0.010mol/L的D的氯化物和F的最高价氯化物的混合溶液中逐滴滴入0.020mol/L的NaOH溶液,溶液的pH随着滴入NaOH溶液的变化曲线如图所示:

已知:D和F的最高价氧化物的水化物的溶度积分别为Ksp(D)=1.30×10-33、Ksp(F)=4.0×10-38。
①图像中产生F的最高价氧化物的水化物的沉淀曲线为 (填字母)
a.bc段 b.cd段 c.de段 d.ef段
②沉淀量最大的点为 (填图像中合适的字母)。