题目内容
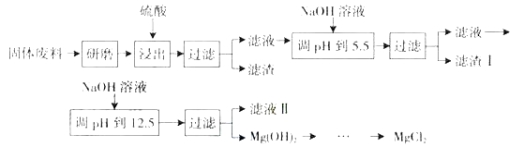
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的 吸收.
a.浓H2SO4b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为 g.
【答案】(1)cd;
(2)Fe3+取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去;
(3)3Cu2O+2Al![]() Al2O3+6Cu;
Al2O3+6Cu;
(4)16g
【解析】试题分析:(1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,A.浓H2SO4不能吸收二氧化硫,a项错误;B.稀HNO3可以吸收二氧化硫,但生成NO污染大气,b项错误;C.NaOH溶液与二氧化硫反应生成亚硫酸钠,c项正确;D.氨水与二氧化硫反应生成亚硫酸铵,d项正确;答案选cd;
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;Fe2+具有还原性,可以利用KMnO4溶液检验,方法是取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去。
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu,反应方程式为3Cu2O+2Al![]() Al2O3+6Cu;
Al2O3+6Cu;
(4)泡铜的主要成分为铜和Cu2O,2240mLNO气体的物质的量为0.1mol,铜与硝酸反应生成硝酸铜、NO和水,Cu2O与硝酸反应生成硝酸铜、NO和水,取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,根据氮原子守恒得,n[Cu(NO3)2]×2+0.1=0.6,n[Cu(NO3)2]=0.25mol,另取等量的泡铜,用足量的H2还原,得到的铜等于硝酸铜中的铜,为0.25mol,则得到的铜的质量为64g/mol×0.25mol=16g.