题目内容
4.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.下列实验或说法不合理的是( )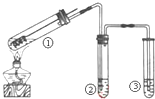
| A. | 上下移动①中铜丝可控制SO2的量 | |
| B. | ②中选用品红溶液验证SO2的生成,③中选用NaOH溶液吸收多余的SO2 | |
| C. | 由于SO2易溶于水,实验时易发生倒吸现象,在①与②之间可加装防倒吸装置 | |
| D. | 为确认CuSO4生成,向①中加水,观察颜色 |
分析 A.铜与浓硫酸只有接触才能发生反应;
B.依据二氧化硫的漂白性、酸性氧化物的性质解答;
C.依据二氧化硫易溶于水的性质解答;
D.根据溶液颜色的变化判断是否有CuSO4生成.
解答 解:A.当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故A正确;
B.SO2具有漂白性,可用品红溶液验证SO2的生成,二氧化硫有毒,为酸性氧化物,能够与氢氧化钠溶液反应被氢氧化钠吸收,故B正确;
C.SO2易溶于水,实验时易发生倒吸现象,在①与②之间可加装防倒吸装置,故C正确;
D.CuSO4溶液呈蓝色,可依据溶液颜色的变化判断是否有CuSO4生成,故D错误;
故选:D.
点评 本题考查二氧化硫的制备和性质,熟悉二氧化硫的性质是解题关键,侧重考查学生对基础知识的掌握,题目难度不大.

练习册系列答案
相关题目
14.某温度下,100mL 0.4mol/L醋酸溶液与足量Zn粒反应生成H2的速率v(H2)=0.01mol/(L•min).为了减缓反应速率,但又不影响生成H2的总量,下列有关说法正确的是( )
| A. | 可向该溶液中加少量CaCO3固体 | |
| B. | 可向该溶液中加入10 mL 0.1 mol/L醋酸溶液 | |
| C. | 可向该溶液中加入少量NaNO3溶液 | |
| D. | 若向该溶液中加入少量醋酸钠固体,反应速率可能变成v(H2)=0.3 mol/(L•h) |
15.元素的种类比核素的种类( )
| A. | 多 | B. | 少 | C. | 相等 | D. | 不能确定 |
12.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 双氧水催化分解 | B. | 乙醇燃烧 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 氯化铵与氢氧化钡晶体反应 |
19.下列关于钠及其化合物的说法错误的是( )
| A. | 钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色 | |
| B. | 切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应 | |
| C. | 过氧化钠在潮湿空气放置一段时间变成白色粘稠物发生了2Na2O2+2H2O═4NaOH+O2反应 | |
| D. | 过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气 |
9.某K2CO3样品可能含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将13.8g样品加入足量水,样品全部溶解,再加入过量CaCl2溶液,得到9g沉淀.以下对样品所含杂质的判断正确的是( )
| A. | 肯定有KNO3 | B. | 肯定没有Ba(NO3)2,可能含有KNO3 | ||
| C. | 肯定没有Ba(NO3)2和Na2CO3 | D. | 肯定有KNO3,可能还含有Na2CO3 |
16.下列实验现象与书写的化学方程式相吻合的是( )
| A. | 有大量白雾产生的反应:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | |
| B. | 有白色沉淀生成的反应:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | |
| C. | 有溶液颜色变化的反应:Zn+2HCl═ZnCl2+H2↑ | |
| D. | 黑色固体变成红色固体的反应:CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 |
13.一定温度下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=5的H2S溶液中:c(OH-)+c(HS-)=1×10-5mol•L-1 | |
| B. | pH相同的①NH4F ②NH4Cl ③NH4Al(SO4)2三种溶液的物质的量浓度 ①>②>③ | |
| C. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) | |
| D. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |