题目内容
19.(1)下列两组物质:①CO2、P2O5、CaO、SO2,②Cu、Mg、Zn、Al.每组中有一种物质在某些化学性质或分类上与其他几种物质不同,这两种物质是①CaO,②Cu.(2)有以下6个反应(反应条件略):
A.2Na+2H2O═2NaOH+H2↑ B.CH4+2O2═CO2+2H2O
C.KClO3═2KCl+3O2↑ D.CaCO3+2HCl═CaCl2+H2O+CO2↑
E..Na2O+CO2═Na2CO3 F.CO2+C═2CO
属于化合反应的有EF(填编号,下同),属于分解反应的有C,属于复分解反应的有D,属于置换反应的有A,属于氧化还原反应的有ABCF.
分析 (1)根据物质的组成和性质判断:CaO是金属氧化物,其它是非金属氧化物;铜与酸不反应,其它金属都能与盐酸反应产生氢气;
(2)化合反应:两种或两种以上物质反应后生成一种物质的反应,其特点可总结为“多变一”;
分解反应:一种物质反应后生成两种或两种以上的物质,其特点可总结为“一变多”;
置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应;
复分解反应是两种化合物相互交换成分生成两种新的化合物的反应;
有化合价变化的反应属于氧化还原反应.
解答 解:(1)CaO是金属氧化物,其它是非金属氧化物;铜与酸不反应,其它金属都能与盐酸反应产生氢气,故答案为:CaO;Cu;
(2)A.2Na+2H2O═2NaOH+H2↑,属于置换反应;
B.CH4+2O2→CO2+2H2O,不属于四种基本反应类型;
C.2KClO3═2KCl+3O2↑,属于分解反应;
D.CaCO3+2HCl═CaCl2+H2O+CO2↑,属于复分解反应;
E.Na2O+CO2═Na2CO3 属于化合反应;
F.CO2+C═2CO属于化合反应;
A.2Na+2H2O═2NaOH+H2↑,B.CH4+2O2→CO2+2H2O,C.2KClO3═2KCl+3O2↑,F.CO2+C═2CO都有化合价的变化,属于氧化还原反应;
故答案为:EF;C;D;A;ABCF.
点评 本题考查了化学的基本概念和反应类型的判断,熟悉概念的内涵和外延是解题关键,注意分析氧化还原反应,应抓住化合价的变化,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
10.下列变化中,涉及不到化学变化的是( )
| A. | 石油的分馏 | B. | 氯气溶于水 | C. | 食物腐败 | D. | 煤的干馏 |
7.某同学进行实验研究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2•8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.为探究其原因,该同学查得Ba(OH)2•8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6.
(1)烧杯中未溶物可能仅为BaCO3,理由是Ba(OH)2•8H2O与CO2作用转化为BaCO3.
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成.设计实验方案,进行成分检
验.写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管带塞导气管、滴管
(3)将试剂初步提纯后,准确测定其中Ba(OH)2•8H2O的含量.实验如下:
①配制250mL约0.1mol•L-1 Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,溶解,将溶液转入250ml的容量瓶中,洗涤,定容,摇匀.
②滴定:准确量取25.00mL所配Ba(OH)2溶液于锥形瓶中,滴加指示剂,将0.1980(填“0.0210”、“0.0536”、“0.1980”或“1.5000”)mol•L-1盐酸装入50mL酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸V mL.
③计算Ba(OH)2•8H2O的质量分数=$\frac{0.25L×\frac{0.198V}{50}mol×315g/mol}{wg}$×100%(只列出算式,不做运算).
(4)室温下,不能(填“能”或“不能”) 配制1.0 mol•L-1 Ba(OH)2溶液.
(1)烧杯中未溶物可能仅为BaCO3,理由是Ba(OH)2•8H2O与CO2作用转化为BaCO3.
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成.设计实验方案,进行成分检
验.写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | |
| 步骤3:取适量步骤1中的沉淀于试管中,取适量步骤1中的沉淀于试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中. | |
| 步骤4:取适量滤液于烧杯中,用pH计测其 pH值 |
①配制250mL约0.1mol•L-1 Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,溶解,将溶液转入250ml的容量瓶中,洗涤,定容,摇匀.
②滴定:准确量取25.00mL所配Ba(OH)2溶液于锥形瓶中,滴加指示剂,将0.1980(填“0.0210”、“0.0536”、“0.1980”或“1.5000”)mol•L-1盐酸装入50mL酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸V mL.
③计算Ba(OH)2•8H2O的质量分数=$\frac{0.25L×\frac{0.198V}{50}mol×315g/mol}{wg}$×100%(只列出算式,不做运算).
(4)室温下,不能(填“能”或“不能”) 配制1.0 mol•L-1 Ba(OH)2溶液.
14.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 18gD2O和18gH2O中含有的质子数均为10NA |
4.下列仪器中,不能加热使用的是( )
| A. | 锥形瓶 | B. | 试管 | C. | 容量瓶 | D. | 烧杯 |
11.下列溶液中,氯离子的物质的量浓度与50mL 1mol•L-1氯化铝溶液中氯离子的物质的量浓度相等的是( )
| A. | 150 mL 1 mol•L-1氯化钠溶液 | B. | 75 mL 1.5 mol•L-1氯化钾溶液 | ||
| C. | 150 mL 3 mol•L-1氯化钾溶液 | D. | 50 mL 3 mol•L-1氯化镁溶液 |
8.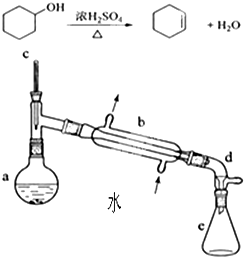 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:
实验步骤:
1、[合成]:在a中加入适量纯环己醇及2小块沸石,冷却搅动下缓慢加入1 mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
2、[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得纯环己烯.
回答下列问题:
(1)装置b的名称是冷凝管.加入沸石的目的是防暴沸.
(2)本实验中最容易产生的有机副产物的结构简式为 .
.
(3)分液漏斗在使用前必须清洗干净并检漏.本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(4)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4加入无水CaCl2的作用是干燥所得环己烯.
 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
1、[合成]:在a中加入适量纯环己醇及2小块沸石,冷却搅动下缓慢加入1 mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
2、[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得纯环己烯.
回答下列问题:
(1)装置b的名称是冷凝管.加入沸石的目的是防暴沸.
(2)本实验中最容易产生的有机副产物的结构简式为
 .
.(3)分液漏斗在使用前必须清洗干净并检漏.本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(4)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4加入无水CaCl2的作用是干燥所得环己烯.
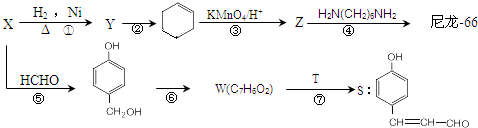
 ,T的分子式为C2H4O.
,T的分子式为C2H4O. .
.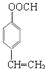 .
.